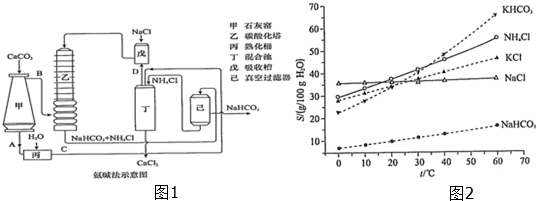
题目内容
6.已知SO2 可以用Fe(NO3)3溶液吸收,某学习小组据此按如图装置展开如下相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2 后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀.

回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为分液漏斗;检查图中连通装置A、B气密性的方法是关闭弹簧夹1和弹簧夹2,打开分液漏斗活塞,向漏斗中加水至水流下,停止加水,观察一段时间液面不下降,则气密性好,否则不好.
(2)加入浓硫酸之前先通入N2一段时间,其目的是排除空气的干扰;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是饱和NaHSO3溶液;若用NaOH溶液处理尾气,则发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应
假设2:SO2被Fe3+氧化为SO42-
假设3:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2.
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论.
| 实验步骤(简述操作过程) | 预期现象和结论 |
| ①测1.0mol/L Fe(NO3)3溶液的pH ② ③ ④ |
分析 (1)该仪器名称是分液漏斗;利用产生的压强差检验装置的气密性;
(2)空气中氧气能氧化亚铁离子干扰实验;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,C中盛放的物质能吸收硫酸且不能吸收二氧化硫、不能引进新的杂质;二氧化硫属于酸性氧化物,能和碱反应生成盐和水;
(3)铁离子具有氧化性,将SO2氧化为SO42-;
(4)要验证假设3,硝酸铁是强酸弱碱盐,其溶液呈酸性,要证明是酸性条件下硝酸根离子氧化二氧化硫,可以用硝酸的强碱盐溶液、少量稀硝酸,然后向溶液中通入少量二氧化硫观察实验现象.
解答 解:(1)该仪器名称是分液漏斗;
其检验方法为关闭弹簧夹1和弹簧夹2,打开分液漏斗活塞,向漏斗中加水至水流下,停止加水,观察一段时间液面不下降,则气密性好,否则不好,
故答案为:分液漏斗;关闭弹簧夹1和弹簧夹2,打开分液漏斗活塞,向漏斗中加水至水流下,停止加水,观察一段时间液面不下降,则气密性好,否则不好;
(2)装置中含有空气,空气中氧气能氧化亚铁离子干扰实验,所以通入氮气的目的是排除空气的干扰;
排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,C中盛放的物质能吸收硫酸且不能吸收二氧化硫、不能引进新的杂质,则需要饱和的饱和NaHSO3溶液;二氧化硫属于酸性氧化物,能和碱溶液发生反应生成盐和水,离子方程式为SO2+2OH-=SO32-+H2O,
故答案为:排除空气的干扰;饱和NaHSO3溶液;SO2+2OH-=SO32-+H2O;
(3)铁离子具有氧化性、二氧化硫具有还原性,二者发生氧化还原反应生成硫酸根离子,
故答案为:SO2被Fe3+氧化为SO42-;
(4)要验证假设3,硝酸铁是强酸弱碱盐,其溶液呈酸性,要证明是酸性条件下硝酸根离子氧化二氧化硫,可以用硝酸的强碱盐溶液、少量稀硝酸,然后向溶液中通入少量二氧化硫观察实验现象,
其操作步骤为:
②取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中;
③向试管中滴加少许稀硝酸,调节pH与①相同;
④向试管中通入适量SO2气体,
通过以上一系列操作,如果溶液中有白色沉淀生成就说明假设3成立,否则假设3不成立,
故答案为:
| 实验步骤(简述操作过程) | 预期现象和结论 |
| ②取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中; ③向试管中滴加少许稀硝酸,调节pH与①相同; ④向试管中通入适量SO2气体 | 若有白色沉淀,则假设3成立; 反之,则假设3不成立 |
点评 本题考查性质实验方案设计,为高频考点,侧重考查学生实验操作、实验设计能力及思维缜密性,明确反应原理是解本题关键,难点是(4)题实验设计,要考虑硝酸根离子浓度、溶液pH,注意操作先后顺序,题目难度中等.

| A. | 加入氯水振荡,观察水层是否有棕红色溴出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |


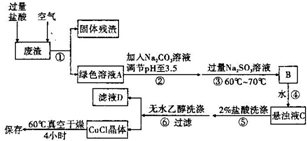 通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.
通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.