题目内容
18.有时为了方便,装置示意图中的仪器可以用图1的方式表示.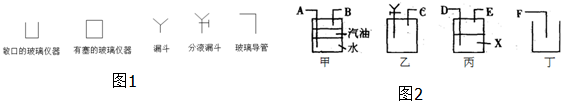
某Na2SO3样品,其中可能含Na2SO4、K2SO4、K2CO3、NaCl中的一种或几种.为测定样品成分及其含量,称取样品5.0g,加入5mL 6mol/L的硫酸(过量),标准状况下测定气体的体积.向逸出气体后的溶液中滴加足量BaCl2溶液,过滤得沉淀9.32g.取滤液作焰色反应实验,隔着蓝色钴玻璃观察无紫色.
(1)用图2仪器组装实验,气流从左向右各管口联接顺序是AEFDCB.
(2)丙中X液体是浓H2SO4,丁中的玻璃容器最好用量筒;甲中汽油的作用是防止SO2与水接触,目的是防止因气体被水吸收产生误差.
(3)要准确测定生成气体的体积,简述有关操作及注意事项.
(4)实验结束时测得丁中液体的体积为560mL,通过计算和推断,确定样品的组分及各组分的质量分数.
分析 称量此样品6.30g,加入6.0mol•L-1的硫酸至过量,产生无色气体560mL(标准状况),透过蓝色钻玻璃观察,滤液的焰色反应无紫色,说明无钾离子,证明混合物中一定无KNO3、K2CO2、K2SO4;产生无色气体560mL(标准状况)是二氧化硫物质的量为0.025mol;向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,判断为硫酸钡沉淀物质的量=$\frac{9.32g}{233g/mol}$=0.04mol;
(1)该实验的流程为:气体发生-气体干燥-排液体测体积,根据发生装置、干燥装置、排水装置和收集装置排序;
(2)丙图是洗气瓶,除去二氧化硫气体中的水蒸气;用量筒测定排除的水的体积;甲图中是排水量气测定二氧化硫的体积的装置,所以汽油是防止二氧化硫和水接触反应,气体SO2易溶于水排液体时汽油起到与水隔绝的作用;
(3)操作时,若要正确地测出放出气体的体积甲与量筒的液面要相同,读数要准确,排水量气装置测量气体的条件,利用的原理是气体排出液体进入量筒中读出液体的体积即为气体的体积;满足的条件是,冷却到室温,量筒和广口瓶液面相平,读出体积;
(4)据二氧化硫的体积求出其物质的量即为Na2SO3的物质的量,求出质量便可求质量分数,由焰色反应知无KNO3、K2CO3、K2SO4;白色沉淀9.32 g的物质的量大于硫酸的物质的量可知有Na2SO4并可求其质量,由总质量、Na2SO3质量可知还有NaCl.
解答 解:(1)该实验的流程为:气体发生-气体干燥-排液体测体积,根据发生装置、干燥装置、排水装置和收集装置排序,装置连接顺序接口为:A E F D C B;
故答案为:A;E;F;D;C;B;
(2)丙装置是洗气瓶,除去二氧化硫气体中的水蒸气,X溶液是浓H2SO4;用量筒测定排除的水的体积,水的体积即是气体的体积,所以选用量筒;甲图中是排水量气测定二氧化硫的体积的装置,二氧化硫难溶于汽油,而易溶于水,所以汽油是防止二氧化硫和水接触反应,以免使二氧化硫被水产生误差;
故答案为:浓H2SO4;量筒;防止SO2与水接触;防止因气体被水吸收产生误差;
(3)排水量气装置测量气体的条件,利用的原理是气体排出液体进入量筒中读出液体的体积即为气体的体积;满足的条件是,冷却到室温,量筒和广口瓶液面相平,读出体积,
故答案为:反应装置冷至室温后,再上下移动量筒,使量筒与甲瓶内液面保持水平,然后读取体积;
(4)加入6.0mol•L-1的硫酸至过量,若实验中加入硫酸溶液的体积为5.00mL,产生无色气体560mL(标准状况)二氧化硫物质的量为0.025mol;
则亚硫酸钠的物质的量为0.025mol,质量分数=$\frac{0.025mol×126g/mol}{5.0g}$×100%=63%;
得到白色沉淀9.32g,判断为硫酸钡沉淀物质的量=$\frac{9.32g}{233g/mol}$=0.04mol;加入的硫酸物质的量为0.03mol,说明一定含有硫酸钠,质量为0.01mol×142g/mol=1.42g,其质量分数为:$\frac{1.42g}{5.0g}$×100%=28.4%;
亚硫酸钠的物质的量为0.025mol,质量=0.025mol×126g/mol=3.15g,剩余固体质量为5.0g-1.42g-3.15g=0.43g,
由焰色反应知无KNO3、K2CO3、K2SO4,所以一定含有NaCl,则NaCl的质量分数为$\frac{0.43g}{5.0g}$×100%=8.6%;
答:混合物中含有Na2SO3质量分数为63%,Na2SO4质量分数为28.4%,NaCl质量分数为8.6%.
点评 本题考查了物质组成的测定实验探究,注意把握实验设计的依据和步骤,掌握物质的性质和实验基本操作是解题关键,题目难度中等,侧重于考查学生的实验探究能力和计算能力.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 加压 | B. | 加催化剂 | C. | 降温 | D. | 升温 |
| A. | 阴、阳离子间通过静电引力而形成的化学键称为离子键 | |
| B. | 在MgO和CO2 晶体中都不存在单个分子 | |
| C. | 金属中存在自由移动的带电微粒,所以能导电 | |
| D. | 离子晶体中存在带电微粒,所以能导电 |
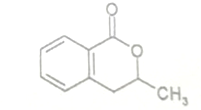
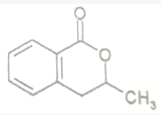 +H2O$\stackrel{NaOH}{→}$
+H2O$\stackrel{NaOH}{→}$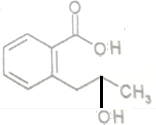 .
.
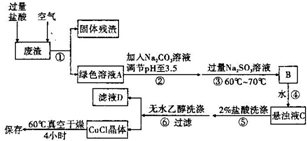 通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.
通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.