题目内容
15.下列有关化学用语表示不正确的是( )| A. | 甲酸乙酯的结构简式:HCOOCH2CH3 | |
| B. | 质子数为53,中子数为75的碘原子:${\;}_{53}^{128}$I | |
| C. | 四氯化碳的电子式: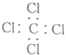 | |
| D. | 间甲基苯酚: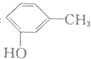 |
分析 A.甲酸甲酯为甲酸和乙醇反应生成的酯;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.四氯化碳中,C、Cl原子最外层都达到8电子稳定结构,漏掉了氯原子的3对未成键电子对;
D.间甲基苯酚中,甲基在酚羟基的间位碳上.
解答 解:A.甲酸和乙醇反应生成甲酸乙酯,则甲酸乙酯的结构简式为:HCOOCH2CH3,故A正确;
B.质子数为53,中子数为75的碘原子质量数为128,该原子可以表示为:${\;}_{53}^{128}$I,故B正确;
C.四氯化碳为共价化合物,碳原子和氯原子最外层都达到8电子稳定结构,四氯化碳的电子式为: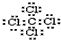 ,故C错误;
,故C错误;
D.间甲基苯酚中,甲基与酚羟基处于间位,其结构简式为: ,故D正确;
,故D正确;
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,涉及结构简式、电子式、元素符号等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
15.A、B、C、D、E为短周期元素,其原子序数依次增大.其中A的最外层电子数为其周期数的2倍;B和D为同主族元素,其中B的氢化物在常温下为液态;C的+1价离子比E的-1价离子少8个电子.则下列说法正确的是( )
| A. | D氢化物的稳定性比B氢化物的稳定性强 | |
| B. | 5种元素中,E元素氧化物的水合物的酸性最强 | |
| C. | A与B、D分别可形成AB2、AD2的化合物 | |
| D. | B和C可形成离子化合物,且C离子的半径大于B离子的半径 |
3.已知:①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
②N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ•mol-1
③N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ•mol-1
则4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)△H=XkJ•mol-1中X的值是( )
②N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ•mol-1
③N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ•mol-1
则4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)△H=XkJ•mol-1中X的值是( )
| A. | -1131.2 | B. | -647.6 | C. | -507.8 | D. | -323.8 |
10.某金属晶体的晶胞如图所示,下列有关说法中正确的是( )
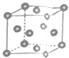

| A. | 只有金属钋原子采用这种堆积方式 | B. | 这种堆积方式中,配位数为8 | ||
| C. | 这是金属晶体的一种最密堆积方式 | D. | 这种堆积方式的空间利用率较低 |
20.下列说法正确的是( )
| A. | 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙酯 | |
| B. | 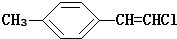 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. | 1 mol阿司匹林(结构简式见图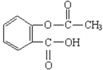 )与足量的氢氧化钠溶液加热反应,最多消耗的氢氧化钠的物质的量2 mol )与足量的氢氧化钠溶液加热反应,最多消耗的氢氧化钠的物质的量2 mol |
4.工业上用洗净的废铜屑作原料来制备硝酸铜,为了节约原料,宜采取的方法是( )
| A. | Cu+HNO3(浓)→Cu(NO3)2 | |
| B. | Cu+HNO3(稀)→Cu(NO3)2 | |
| C. | Cu$→_{△}^{空气}$Cu$\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| D. | Cu $→_{△}^{浓硫酸}$ CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |

 .
.