题目内容
2.如图是锂-空气电池放电和充电时的工作示意图.下列说法正确的是( )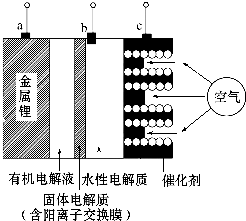
| A. | 该电池放电时,图中电极a是正极,c是负极 | |
| B. | 该电池放电时,水性电解质pH不变 | |
| C. | 当给该锂-空气电池充电时,c极应接电源的负极 | |
| D. | 当给该锂-空气电池充电时,b极的电极反应式为4OH--4e-=2H2O+O2↑ |
分析 放电时,该电池反应式中元素化合价变化为:Li元素由0价变为+1价,O元素化合价由0价变为-2价,所以Li作负极,氧气作正极,充电时,正极与电源正极相连为阳极失电子发生氧化反应,负极与电源负极相连为阴极得电子发生还原反应.
解答 解:A.放电时,该电池反应式中元素化合价变化为:Li元素由0价变为+1价,O元素化合价由0价变为-2价,所以a是负极,c是正极,故A错误;
B.放电时,正极上电极反应式为O2+2H2O+4e-═4OH-,正极附近生成氢氧根离子,导致氢氧根离子浓度增大,则溶液的pH增大,故B错误;
C.充电时,正极与电源正极相连为阳极失电子发生氧化反应,所以正极c极应接电源的正极,故C错误;
D.该锂-空气电池充电时,c极应接电源的正极为阳极,电极反应式为4OH--4e-=2H2O+O2↑,故D正确;
故选D.
点评 本题考查了化学电源新型电池,明确原电池原理和电解池原理是解答本题关键,再结合电极反应式解答,注意电极反应式的书写,难度中等.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
12.下列物质中既能与稀硫酸反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
| A. | ③④ | B. | ①②③④ | C. | ①③④ | D. | ①②⑤ |
13.某小组同学利用铝和氧化铁发生铝热反应后得到的固体进行如下实验.
(1)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)固体成分的初步确定.
①由上述实验可知:溶液中Fe元素的存在形式有Fe2+、Fe3+.
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑.进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
提示:KSCN中S元素的化合价为-2价
①实验ⅲ中白色沉淀的化学式是BaSO4.
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
(1)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)固体成分的初步确定.
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑.进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
| 实验序号 | 操作、现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2,无明显变化.再加入H2O2溶液,红色很快褪去 |
①实验ⅲ中白色沉淀的化学式是BaSO4.
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
17.Na、Mg、Al三种金属各2mol分别跟1L 1mol?L-1的盐酸反应时,相同条件下放出氢气体积最大的是( )
| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者产生的氢气一样多 |
14.在N2+3H2?2NH3的反应中,经过一段时间后,H2的浓度减少了0.9mol/L,在这段时间内用H2表示的平均反应速率为0.45mol/(L•s),则这段时间是( )
| A. | 1s | B. | 2s | C. | 4.4s | D. | 1.33s |
11.H2S的水溶液中存在平衡:H2S?HS-+H+ 和HS-?S2-+H+,当增大溶液的pH时,c(S2-)怎样变化( )
| A. | 增大 | B. | 减小 | ||
| C. | 不变 | D. | 可能增大也可能减小 |