题目内容
17.Na、Mg、Al三种金属各2mol分别跟1L 1mol?L-1的盐酸反应时,相同条件下放出氢气体积最大的是( )| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者产生的氢气一样多 |
分析 根据三种金属的化合价可得与盐酸反应的关系式分别为:2Na~H2,2Mg~2H2,2Al~3H2,根据反应的方程式计算金属和氯化氢反应的定量关系分析判断.
解答 解:若将三种金属各2mol分别投入1L 1mol/L的盐酸中,反应定量关系为:2Na~2HCl~H2,2Mg~4HCl~2H2,2Al~6HCl~3H2,可知三种金属都过量,但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,镁和铝生成氢气的体积一样多,生成氢气体积大小为,Na>Mg=Al.
故选C.
点评 本题考查化学方程式的计算,题目难度不大,注意根据化学方程式判断有关反应的量的关系.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案
相关题目
8.下列离子方程式正确的是( )
| A. | 足量的SO2通入氨水中:SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| B. | SO2通入溴水中:Br2+SO2+2H2O═2H++SO42-+2HBr | |
| C. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 酸雨久置pH变小:2H2SO3+O2═4H++2SO42- |
5.在一定温度下,下列叙述中属于可逆反应A(g)+B(g)?2C(g)达到平衡标志的是( )
| A. | C的生成速率与C的分解速率相等 | |
| B. | 混合气体的压强不再变化 | |
| C. | 单位时间内消耗a mol A的同时消耗a mol B | |
| D. | A、B、C的物质的量之比为1:1:2 |
2.如图是锂-空气电池放电和充电时的工作示意图.下列说法正确的是( )
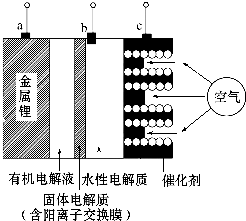

| A. | 该电池放电时,图中电极a是正极,c是负极 | |
| B. | 该电池放电时,水性电解质pH不变 | |
| C. | 当给该锂-空气电池充电时,c极应接电源的负极 | |
| D. | 当给该锂-空气电池充电时,b极的电极反应式为4OH--4e-=2H2O+O2↑ |
9.在反应8NH3+3Cl2=N2+6NH4Cl中,被氧化的物质与被还原的物质的分子数之比为( )
| A. | 8:3 | B. | 3:8 | C. | 2:3 | D. | 1:3 |
6.1.12克铁粉加入25mL 2mol/L的氯化铁溶液中,正确的是( )
| A. | 溶液中[Fe2+]<[Fe3+] | |
| B. | 溶液中[Fe2+]>[Fe3+] | |
| C. | 部分Fe3+被氧化 | |
| D. | 在反应后的溶液中加入KSCN溶液,会出现血红色沉淀 |
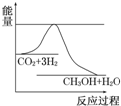 目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2反应.
目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2反应.