题目内容
14.在N2+3H2?2NH3的反应中,经过一段时间后,H2的浓度减少了0.9mol/L,在这段时间内用H2表示的平均反应速率为0.45mol/(L•s),则这段时间是( )| A. | 1s | B. | 2s | C. | 4.4s | D. | 1.33s |
分析 依据题意得知利用氢气表示的化学反应速率为0.45mol/(L×s),浓度的变化为0.9mol/L,再根据t=$\frac{△c}{v}$计算时间.
解答 解:H2 表示的平均速率v(H2 )=0.45mol/(L?s),氢气的浓度增加了0.9mol/L,即△c(H2)=0.9mol/L,所以反应所经历的时间为$\frac{0.9mol/L}{0.45mol/(L•s)}$=2s,
故选:B.
点评 本题考查化学反应速率的有关计算,难度不大,注意对公式的理解与灵活运用.

练习册系列答案
相关题目
5.在一定温度下,下列叙述中属于可逆反应A(g)+B(g)?2C(g)达到平衡标志的是( )
| A. | C的生成速率与C的分解速率相等 | |
| B. | 混合气体的压强不再变化 | |
| C. | 单位时间内消耗a mol A的同时消耗a mol B | |
| D. | A、B、C的物质的量之比为1:1:2 |
2.如图是锂-空气电池放电和充电时的工作示意图.下列说法正确的是( )
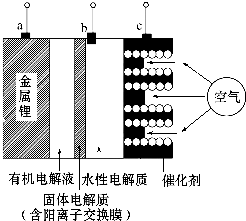

| A. | 该电池放电时,图中电极a是正极,c是负极 | |
| B. | 该电池放电时,水性电解质pH不变 | |
| C. | 当给该锂-空气电池充电时,c极应接电源的负极 | |
| D. | 当给该锂-空气电池充电时,b极的电极反应式为4OH--4e-=2H2O+O2↑ |
9.在反应8NH3+3Cl2=N2+6NH4Cl中,被氧化的物质与被还原的物质的分子数之比为( )
| A. | 8:3 | B. | 3:8 | C. | 2:3 | D. | 1:3 |
19.常温下,pH=2的强酸溶液与pH=13的强碱溶液混合后,所得溶液的pH=11,则强酸和强碱的体积比为( )
| A. | 1:9 | B. | 9:1 | C. | 1:11 | D. | 11:1 |
6.1.12克铁粉加入25mL 2mol/L的氯化铁溶液中,正确的是( )
| A. | 溶液中[Fe2+]<[Fe3+] | |
| B. | 溶液中[Fe2+]>[Fe3+] | |
| C. | 部分Fe3+被氧化 | |
| D. | 在反应后的溶液中加入KSCN溶液,会出现血红色沉淀 |
 实验室需要配制0.1mol/L NaOH溶液450mL,回答下列问题:
实验室需要配制0.1mol/L NaOH溶液450mL,回答下列问题: