题目内容
11.H2S的水溶液中存在平衡:H2S?HS-+H+ 和HS-?S2-+H+,当增大溶液的pH时,c(S2-)怎样变化( )| A. | 增大 | B. | 减小 | ||
| C. | 不变 | D. | 可能增大也可能减小 |
分析 增大溶液的pH的方法有多种,当通过加入碱来增大溶液的pH时,平衡向正向移动,c(S2-)会增大,如果稀释溶液,酸性会减弱,碱性增强,pH增大,此时c(S2-)减小,故c(S2-) 可能增大也可能减小,据此分析.
解答 解:升温平衡正向移动,溶液pH增大,加入碱溶液pH也增大,平衡都正向移动,硫离子浓度增大,加水稀释时溶液酸性减弱,pH增大,各离子浓度都减小,所以当增大溶液的pH时,c(S2-)可能增大也可能减小,故选D.
点评 本题考查了电离平衡移动的影响因素和溶液的pH变化,注意从影响弱电解质电离平衡移动的因素分析,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目
1.如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知,过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将发生的现象是( )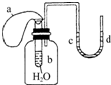

| A. | U形管内红色褪去 | B. | 试管内溶液变红 | C. | 气球a被吹大 | D. | U形管水位d<c |
2.如图是锂-空气电池放电和充电时的工作示意图.下列说法正确的是( )
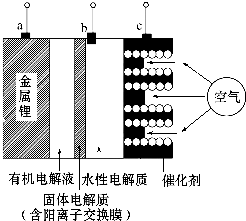

| A. | 该电池放电时,图中电极a是正极,c是负极 | |
| B. | 该电池放电时,水性电解质pH不变 | |
| C. | 当给该锂-空气电池充电时,c极应接电源的负极 | |
| D. | 当给该锂-空气电池充电时,b极的电极反应式为4OH--4e-=2H2O+O2↑ |
19.常温下,pH=2的强酸溶液与pH=13的强碱溶液混合后,所得溶液的pH=11,则强酸和强碱的体积比为( )
| A. | 1:9 | B. | 9:1 | C. | 1:11 | D. | 11:1 |
6.1.12克铁粉加入25mL 2mol/L的氯化铁溶液中,正确的是( )
| A. | 溶液中[Fe2+]<[Fe3+] | |
| B. | 溶液中[Fe2+]>[Fe3+] | |
| C. | 部分Fe3+被氧化 | |
| D. | 在反应后的溶液中加入KSCN溶液,会出现血红色沉淀 |
16.类推法在化学学习中经常采用,下列类推的结论正确的是( )
| A. | 由Cl2+2KBr═2KCl+Br2所以F2也能与KBr溶液反应置换出Br2 | |
| B. | 常温下,由Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,所以Fe也能与浓硝酸反应产生NO2 | |
| C. | 由Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2 所以Cu+I2$\frac{\underline{\;\;△\;\;}}{\;}$CuI2 | |
| D. | 由钠保存在煤油中,所以钾也可以保存在煤油中 |
20.下列是元素A的两种同位素的资料
元素A的近似相对原子质量为104.6(列出计算式)
| 同位素 | 同位素的质量分数 | 原子百分比 |
| 103A | 103 | 20% |
| 105A | 105 | 80% |
1.下列说法错误的是( )
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012kg 12C约含有6.02×1023个碳原子 | |
| C. | 使用物质的量时,应指明粒子的种类 | |
| D. | 1mol H2的质量是2g |