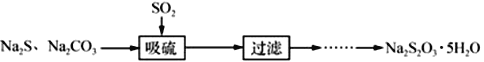
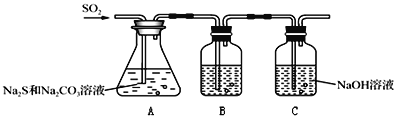
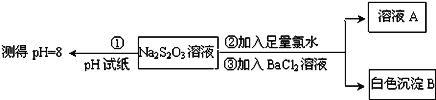
题目内容
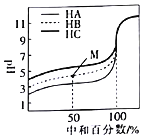
【题目】反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

(1)据图判断该反应是______(填“吸”或“放”)热反应,当反应达 到平衡后,其他条件不变,升高温度,反应物的转化率____(填“增大”、“减小”或“不变”)
(2)其中B历程表明此反应采用的条件为___(选填下列序号字母),作出正确的判断的理由为________
A、升高温度 B、增大反应物的浓度 C、降低温度 D、使用了催化剂
(3)若△H的数值为200kJ/mol,则x值应为__kJ/mol.此反应在A反应历程中的正反应的活化能为 _____kJ/mol。
【答案】吸 增大 D 使用催化剂能降低反应物的活化能 70 +580
【解析】
(1)根据图可知,该反应的反应物的总能量小于生成物的总能量,所以该反应是吸热反应;升高温度,平衡正向移动,反应物的转化率增大;
(2)B历程正反应的活化能降低,所以是使用了催化剂,答案选D;
(3)△H的数值为200 kJ/mol,所以x=70kJ/mol,活化能是反应物达到活化分子时吸收的能量,所以A历程的活化能=650 kJ/mol -70 kJ/mol =+580kJ/mol。

练习册系列答案
相关题目
【题目】某温度下,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]() ,经过一段时间后反应达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
,经过一段时间后反应达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是![]()
![]()
| 0 | 5 | 15 | 25 | 35 |
|
|
|
|
|
|
A.前![]() 的平均反应速率
的平均反应速率![]()
B.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
C.相同温度下,起始时向容器中充入![]() ,达到平衡时C的转化率大于
,达到平衡时C的转化率大于![]()
D.相同温度下,起始时向容器中充入![]() 、
、![]() 和
和![]() ,反应达到平衡前
,反应达到平衡前![]() 正
正![]() 逆
逆![]()