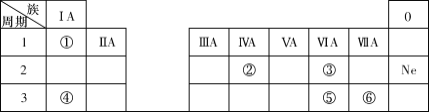
题目内容
【题目】常温下,下列溶液中的pH判断或各微粒浓度关系,不正确的是( )
A.将![]() 的
的![]() 溶液与
溶液与![]() 溶液充分混合,若混合后溶液的体积为10mL,则混合液的
溶液充分混合,若混合后溶液的体积为10mL,则混合液的![]()
B.将![]() 的某一元酸HA溶液和
的某一元酸HA溶液和![]() 溶液等体积混合,混合液pH大于7,则反应后的混合液中:
溶液等体积混合,混合液pH大于7,则反应后的混合液中:![]()
C.pH相等的![]()
![]()
![]() 溶液中,
溶液中,![]() 大小关系:
大小关系:![]()
D.常温下,![]() 的
的![]() 和NaClO的混合溶液中:
和NaClO的混合溶液中:![]()
【答案】B
【解析】
A.常温下将![]() 溶液与
溶液与![]() 溶液充分混合,硫酸过量,反应后
溶液充分混合,硫酸过量,反应后![]() ,则
,则![]() ,故A正确;
,故A正确;
B.二者混合后溶液中的溶质是等物质的量浓度的HA和NaA,溶液呈碱性,则:![]() ,说明
,说明![]() 的水解程度大于HA电离程度,则溶液中存在电荷守恒和物料守恒,根据电荷守恒得
的水解程度大于HA电离程度,则溶液中存在电荷守恒和物料守恒,根据电荷守恒得![]() ,根据物料守恒得
,根据物料守恒得![]() ,二者结合可得:
,二者结合可得:![]() ,由于
,由于![]() ,则
,则![]() ,故B错误;
,故B错误;
C.酸性大小为:![]() ,则等浓度的
,则等浓度的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液的pH大小为:
溶液的pH大小为:![]() ,则等PH的
,则等PH的![]()
![]()
![]() 溶液的浓度关系为:
溶液的浓度关系为:![]() ,由于钠离子不水解,则钠离子浓度大小为:
,由于钠离子不水解,则钠离子浓度大小为:![]() ,故C正确;
,故C正确;
D.常温下,![]() 的
的![]() 和NaClO的混合溶液中,根据质子守恒可得:
和NaClO的混合溶液中,根据质子守恒可得:![]() ,整理可得:
,整理可得:![]() ,故D正确;
,故D正确;
故选B。

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.装置甲中W作原电池负极
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置丙中溶液的c(H+)不变
D.四种金属的活动性强弱顺序为Z>W>X>Y