题目内容
【题目】某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀硫酸25mL,滴定终点时消耗NaOH溶液15mL。
(1)该学生用标准0.14mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO425mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
①滴定操作的正确顺序是(用序号填写):________。
②该滴定操作中应选用的指示剂是:_______。
③在G操作中如何确定终点?________。
(2)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度______mol/L。(计算出结果到小数点后二位)
【答案】ECDBAGF(或ECBADGF) 酚酞或甲基橙 酚酞为指示剂时浅红色变为无色且半分钟不复原(或甲基橙为指示剂时黄色变色橙色且半分钟不复原) 4.2
【解析】
(1)①根据酸碱中和滴定操作步骤进行排序;
②根据氢氧化钠与硫酸完全反应后溶液呈中性,可选择酚酞或甲基橙;
③根据滴定结束前硫酸溶液的颜色及反应结束后混合液的颜色变化判断滴定终点;
(2)先根据滴定消耗的氢氧化钠溶液的体积及反应方程式计算出待测液硫酸的物质的量浓度,再根据稀释前后溶质的物质的量不变来计算。
(1)①用标准0.14mol/LNaOH溶液滴定硫酸的实验操作步骤为:检查滴定管是否漏水、洗涤碱式滴定管、润洗并盛装标准液、润洗盛装待测液的酸式滴定管、取待测液于锥形瓶中并滴加指示剂、开始滴定、重复滴定等,所以正确的操作顺序为:ECDBAGF(或ECBADGF);
②氢氧化钠与硫酸完全反应后溶液呈中性,可选择酚酞或甲基橙;
③若选择酚酞,观察到锥形瓶中溶液的颜色由浅红色变为无色,且半分钟不复原,达到滴定终点;若选择甲基橙,观察到溶液由黄色变为橙色,且半分钟不复原,则达到滴定终点;
(2)以0.14mol/L的NaOH溶液滴定上述稀H2SO425mL,滴定终止时消耗NaOH溶液15mL,根据反应:2NaOH+H2SO4=Na2SO4+2H2O,稀释后的硫酸溶液浓度c(H2SO4)=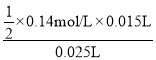 =0.042mol/L,待测硫酸(稀释前的硫酸)溶液的物质的量浓度c(H2SO4)=
=0.042mol/L,待测硫酸(稀释前的硫酸)溶液的物质的量浓度c(H2SO4)=![]() =4.2mol/L。
=4.2mol/L。

【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.装置甲中W作原电池负极
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置丙中溶液的c(H+)不变
D.四种金属的活动性强弱顺序为Z>W>X>Y