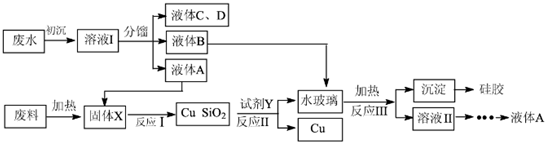
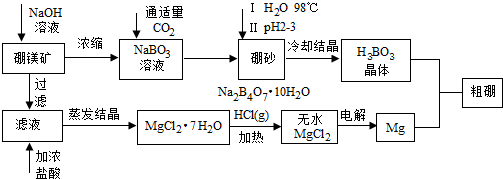
题目内容
20.草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸.某学习小组的同学拟以甘蔗渣为原料用水解一氧化一水解循环进行制取草酸如图1.
请跟据以上信息回答下列问题:
(1)图示①②的氧化一水解过程是在图2的装置三颈烧瓶中进行的,指出装置B的名称球形冷凝管,B装置的作用是冷凝回流硝酸.
(2)图示①②的氧化一水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸收率的影响,结果图3所示,请选择最佳的反应温度为70℃,为了达到图2所示的温度,选择图1的水浴加热,其优点是便于控制温度,使装置受热均匀.
(3)要测定草酸晶体(H2C204+2H20)的纯度,称取7.200g制备的草酸晶体溶于适量水配成 250mL溶液,取25.00mL草酸溶液于锥形瓶中,用0.1000mol/L酸性高锰酸钾溶液滴 定(5H2C2O4+2MnO4-+6H+=2Mn2++10C02T+8H20),
①取25.00mL草酸溶液的仪器是酸式滴定管,
②在草酸纯度测定的实验过程中,若滴定终点读取滴定管刻度时,仰视标准液液面,会使实验结果偏高.(填“偏高”“偏低”或“没有影响”)
③判断滴定已经达到终点的方法是:向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色.
④达到滴定终点时,消耗高锰酸钾溶液共20.00mL,则草酸晶体的纯度为87.5%.
分析 (1)甘蔗渣用稀硫酸浸泡,水解得到葡萄糖,再加入稀硝酸进行氧化得到草酸,在A三颈烧瓶中发生反应;B为球形冷凝管,硝酸易挥发,冷凝回流硝酸;
(2)根据草酸的回收率最高时判断最佳反应温度;由于温度不超过100℃,所以采用水浴加热,便于控制温度,且能使装置受热均匀;
(3)①根据草酸溶液的酸碱性及量取溶液的精确度选用相应的仪器;
②滴定终点读取滴定管刻度时,仰视标准液液面,会使消耗高锰酸钾溶液的体积读数偏大;
③由于酸性高锰酸钾溶液显紫红色,草酸反应完毕,滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红,反应到达终点;
④根据n=cV计算反应中消耗高锰酸钾的物质的量,根据方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O计算草酸的物质的量,再计算原样品中草酸的物质的量,进而计算草酸晶体的纯度.
解答 解:(1)甘蔗渣用稀硫酸浸泡,水解得到葡萄糖,再加入稀硝酸进行氧化得到草酸,在A三颈烧瓶中发生反应;B为球形冷凝管,硝酸易挥发,冷凝回流硝酸,
故答案为:三颈烧瓶;球形冷凝管;冷凝回流硝酸;
(2)根据图3可知,在温度为70℃时,草酸的收率最高,所以选择的最佳反应温度是70℃.由于温度不超过100℃,所以采用水浴加热,便于控制温度,且能使装置受热均匀;
故答案为:70℃;便于控制温度,使装置受热均匀;
(3)①草酸溶液显酸性,所以量取25.00mL草酸溶液的仪器是酸式滴定管,
故答案为:酸式滴定管;
②滴定终点读取滴定管刻度时,仰视标准液液面,会使消耗高锰酸钾溶液的体积读数偏大,导致计算所得草酸的量增大,使实验误差偏高,
故答案为:偏高;
③由于酸性高锰酸钾溶液显紫红色,所以滴定终点的判断依据是向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色;
故答案为:向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色;
④反应中消耗高锰酸钾的物质的量是0.02L×0.1000mol/L=0.002000mol,根据方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,可知25mL溶液中草酸的物质的量是0.002000mol×$\frac{5}{2}$=0.005000mol,因此原样品中草酸的物质的量是0.005000mol×$\frac{250mL}{25mL}$=0.05000mol,则质量=0.05000mol×126g/mol=6.3g,所以草酸的纯度是$\frac{6.3g}{7.2g}$×100%=87.5%.
故答案为:87.5%.
点评 本题考查有机物制备实验方案设计,涉及化学仪器、对装置的分析评价、实验条件的选择控制、物质含量的沉淀、氧化还原反应滴定等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案①苯不能使酸性高锰酸钾溶液褪色;
②苯分子中碳碳键的键长都相等;
③苯能在加热和有催化剂存在的条件下与H2发生加成反应生成环己烷;
④经实验测得邻二甲苯仅有一种结构;
⑤苯在三溴化铁存在的条件下与液溴发生取代反应,但不因化学变化而使溴水褪色.
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②④⑤ | D. | ①②③④ |
| A. | 分别点燃,有黑烟生成的是苯 | |
| B. | 分别加入溴水振荡,静置后分层,上、下两层红棕色均消失的是己烯 | |
| C. | 分别加入溴水振荡,静置后分层,下层红棕色消失的是己烯 | |
| D. | 分别加入酸性高锰酸钾溶液,振荡,静置后水层紫色消失的是己烯 |
| A. | 铜是一种紫红色金属 | |
| B. | 铜是热和电的良导体 | |
| C. | 铜是人类使用最早、应用最广泛的金属之一 | |
| D. | 铜在自然界中主要以单质的形式存在 |
| A. | 含有非极性共价键的化合物分子一定是非极性分子 | |
| B. | 原子晶体中只存在非极性共价键 | |
| C. | 冰主要是水分子通过氢键作用而形成的分子晶体 | |
| D. | 若元素R的含氧酸的酸性大于元素Q的含氧酸的酸性,则非金属性R大于Q |
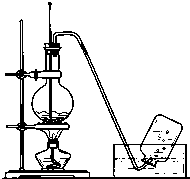 实验室常用如图所示装置制取乙烯,制取时:
实验室常用如图所示装置制取乙烯,制取时: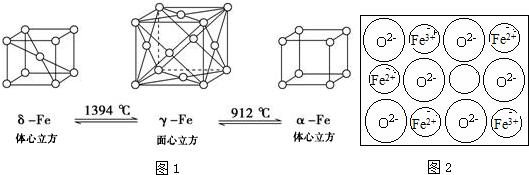
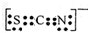 .Fe3+与SCN-可以形成配位数1~6的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.
.Fe3+与SCN-可以形成配位数1~6的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.