题目内容
17.下列有关NA的说法正确的是( )| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2mol NO和1mol O2充分反应,产物的分子数为2NA |
分析 A.重水的摩尔质量为20g/mol,18g重水和水的物质的量不相等,则含有的质子数不相等;
B.亚硫酸为弱酸,在溶液中只能部分电离出离子;
C.过氧化钠中氧元素的化合价为-1价,生成0.1mol氧气转移了0.2mol电子;
D.一氧化氮与氧气反应生成二氧化氮,部分二氧化氮转化成四氧化二氮,则反应产物的分子数减少.
解答 解:A.18g D2O的物质的量为$\frac{18g}{20g/mol}$=0.9mol,0.9mol重水中含有9mol质子,18g H2O的物质的量为1mol,含有10mol质子,二者含有的质子数不相等,故A错误;B.2L 0.5 mol•L-1亚硫酸溶液中含有1mol亚硫酸,由于亚硫酸部分电离出氢离子,则溶液中含有的H+离子数为小于NA,故B错误;
C.过氧化钠中氧元素为-1价,则过氧化钠与水反应时,生成0.1mol氧气转移0.2mol电子,转移的电子数为0.2NA,故C正确;
D.2molNO和1molO2充分反应生成2mol二氧化氮,由于部分二氧化氮转化成四氧化二氮,则反应后产物的总物质的量小于2mol,所以产物的分子数小于2NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确分子、原子、原子核内质子中子及核外电子的构成关系,熟练掌握物质的量与摩尔质量、阿伏伽德罗常数等之间关系.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
4.下列物质属于含有共价键的离子化合物的是( )
| A. | C2H2 | B. | KOH | C. | NaF | D. | C60 |
5.在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被50g质量分数为2.92%的盐酸中和.则该生成物的成分是( )
| A. | Na2O | B. | Na2O2 | C. | Na2O和Na2O2 | D. | 不能确定 |
5.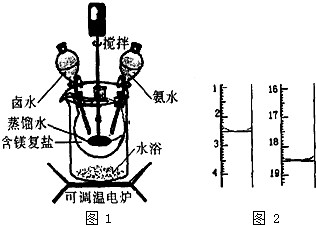 碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
(1)本实验选择水浴加热方式,其优点是使反应物受热均匀,温度容易控制.
(2)40℃时复盐开始热解生成MgCO3•3H2O,并有气体产生,该反应的化学方程式为MgCO3•(NH4)2CO3•H2O+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•3H2O+2NH3↑+CO2↑.
(3)碱式碳酸镁产品中镁的质量分数[w(Mg)%]越高,产品质最越好,氯的质量分数越高,产品质量越差.某科研小组用沉淀滴定法分析产品中C1-的含量,称取6.1000g产品用适量硝酸溶解,经稀释等步骤最终配得500mL的溶液.①在配制过程中必需要用到的一种计量仪器是电子天平或分析天平.准确最取25.00mL待测液,用硝酸银标准液进行滴定,滴定前后滴定管中的液面读数如图2所示,则滴定过程中消耗标准液的体积为16mL.
②已知某温度时,一些银盐的颜色和Ksp如下表:
则滴定时,可用作指示剂的是d.
a.CaCl2b.NaBr c.NaI d.K2CrO4
③滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是碱性条件下,硝酸银会生成氢氧化银或氧化银沉淀.
(4)已知制得的碱式碳酸镁可表示为xMgC03′yMg(OH)2H2O.若碱式碳酸镁的质量ag(不考虑微最杂质),充分灼烧后,测得剩余固体的质量为bg,产生的二氧他碳气体体积在标准状况下为cL,则碱式碳酸镁中x:y=40c:(22.4b-40c).(用b、c表示,不需化简)
 碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.(1)本实验选择水浴加热方式,其优点是使反应物受热均匀,温度容易控制.
(2)40℃时复盐开始热解生成MgCO3•3H2O,并有气体产生,该反应的化学方程式为MgCO3•(NH4)2CO3•H2O+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•3H2O+2NH3↑+CO2↑.
(3)碱式碳酸镁产品中镁的质量分数[w(Mg)%]越高,产品质最越好,氯的质量分数越高,产品质量越差.某科研小组用沉淀滴定法分析产品中C1-的含量,称取6.1000g产品用适量硝酸溶解,经稀释等步骤最终配得500mL的溶液.①在配制过程中必需要用到的一种计量仪器是电子天平或分析天平.准确最取25.00mL待测液,用硝酸银标准液进行滴定,滴定前后滴定管中的液面读数如图2所示,则滴定过程中消耗标准液的体积为16mL.
②已知某温度时,一些银盐的颜色和Ksp如下表:
| 难溶盐 | AgCl | AgBr | AgI | Ag2CrO4 |
| Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 砖红色 |
a.CaCl2b.NaBr c.NaI d.K2CrO4
③滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是碱性条件下,硝酸银会生成氢氧化银或氧化银沉淀.
(4)已知制得的碱式碳酸镁可表示为xMgC03′yMg(OH)2H2O.若碱式碳酸镁的质量ag(不考虑微最杂质),充分灼烧后,测得剩余固体的质量为bg,产生的二氧他碳气体体积在标准状况下为cL,则碱式碳酸镁中x:y=40c:(22.4b-40c).(用b、c表示,不需化简)
12. (1)用轨道示意图表示Fe3+的价电子排布
(1)用轨道示意图表示Fe3+的价电子排布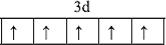 .
.
(2)某主族元素的电离能(电子伏特)如下:
,判断该元素处于VA族;
(3)若ABn的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的是C(填字母).
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确
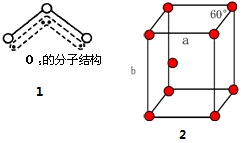
(4)臭氧分子的结构如图1,呈V型,键角116.5°.请回答:
①臭氧与氧气的关系是同素异形体.
②下列分子与臭氧分子的结构最相似的是C(填字母).
A.H2O B.CO2 C.SO2 D.BeCl2
③臭氧分子是否为极性分子是(填“是”或“否”).
(5)在短周期元素中,由三种元素组成的既有离子键又有共价键和配位键,且阴、阳离子所含电子数相差8个,该物质的电子式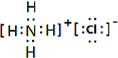 .
.
(6)金属钛为六方最密堆积结构,测得钛的原子半径为r,晶胞结构如图2所示,求该晶胞的边长a=2r,b=$\frac{4\sqrt{6}}{3}$r(用含r的代数式表示)
 (1)用轨道示意图表示Fe3+的价电子排布
(1)用轨道示意图表示Fe3+的价电子排布 .
.(2)某主族元素的电离能(电子伏特)如下:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
(3)若ABn的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的是C(填字母).
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确
(4)臭氧分子的结构如图1,呈V型,键角116.5°.请回答:
①臭氧与氧气的关系是同素异形体.
②下列分子与臭氧分子的结构最相似的是C(填字母).
A.H2O B.CO2 C.SO2 D.BeCl2
③臭氧分子是否为极性分子是(填“是”或“否”).
(5)在短周期元素中,由三种元素组成的既有离子键又有共价键和配位键,且阴、阳离子所含电子数相差8个,该物质的电子式
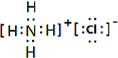 .
.(6)金属钛为六方最密堆积结构,测得钛的原子半径为r,晶胞结构如图2所示,求该晶胞的边长a=2r,b=$\frac{4\sqrt{6}}{3}$r(用含r的代数式表示)
2.设NA 为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.12 L CCl4含有C-Cl键的数目为0.2NA | |
| B. | 1 L 1 mol/L AlCl3溶液中含有NA个Al3+ | |
| C. | 常温常压下,4.4 g CO2与N2O的混合气体中含有的原子总数为0.3NA | |
| D. | 80 mL 10 mol•L-1盐酸与足量MnO2加热反应,产生的Cl2分子数为0.2NA |
9.25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )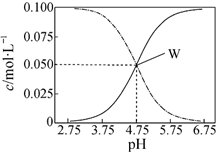

| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) | |
| D. | pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 |
6.下列说法不正确的是( )
| A. | 按系统命名法,化合物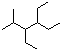 的名称为2-甲基-3,4-二乙基己烷 的名称为2-甲基-3,4-二乙基己烷 | |
| B. | 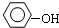 与 与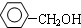 互为同系物 互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
7. 某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为N>O>C.
(2)E的二价离子的电子排布式为1s22s22p63s23p63d9.
(3)A2B2D4是一种有机羧酸,常用作除锈剂,该分子中B的杂化方式为sp2;1mol A2B2D4分子中含有σ键数目为7×6.02×1023.
(4)与化合物BD互为等电子体的阴离子化学式为CN-等(任写一种).
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
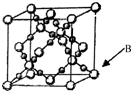
(6)BD2在高温高压下所形成晶体的晶胞如右图所示.一个该晶胞中含16个D原子.
 某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小 |
| B | 原子核外有三种不同的能量的原子轨道且各个轨道所填充的电子数相同 |
| C | 最外层p轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)B、C、D第一电离能由小到大为N>O>C.
(2)E的二价离子的电子排布式为1s22s22p63s23p63d9.
(3)A2B2D4是一种有机羧酸,常用作除锈剂,该分子中B的杂化方式为sp2;1mol A2B2D4分子中含有σ键数目为7×6.02×1023.
(4)与化合物BD互为等电子体的阴离子化学式为CN-等(任写一种).
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(6)BD2在高温高压下所形成晶体的晶胞如右图所示.一个该晶胞中含16个D原子.