题目内容
12. (1)用轨道示意图表示Fe3+的价电子排布
(1)用轨道示意图表示Fe3+的价电子排布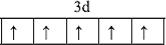 .
.(2)某主族元素的电离能(电子伏特)如下:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
(3)若ABn的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的是C(填字母).
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确
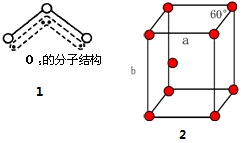
(4)臭氧分子的结构如图1,呈V型,键角116.5°.请回答:
①臭氧与氧气的关系是同素异形体.
②下列分子与臭氧分子的结构最相似的是C(填字母).
A.H2O B.CO2 C.SO2 D.BeCl2
③臭氧分子是否为极性分子是(填“是”或“否”).
(5)在短周期元素中,由三种元素组成的既有离子键又有共价键和配位键,且阴、阳离子所含电子数相差8个,该物质的电子式
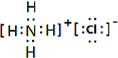 .
.(6)金属钛为六方最密堆积结构,测得钛的原子半径为r,晶胞结构如图2所示,求该晶胞的边长a=2r,b=$\frac{4\sqrt{6}}{3}$r(用含r的代数式表示)
分析 (1)Fe3+的价电子为3d5,根据洪特规则和保利不相容原理画轨道示意图;
(2)该元素第六电离能剧增,则元素原子最外层电子数为5;
(3)若n=2,则分子的立体构型为直线形,若n=3,则分子的立体构型为平面三角形,若n=4,则分子的立体构型为正四面体形;
(4)①O2和O3都是由氧元素形成的不同单质,互为同素异形体;
②O3为V形结构,根据分子中中心原子的价层电子对数判断分子的空间构型;
③分子中正负电荷中心不重合,这样的分子为极性分子;分子中正负电荷的重心重合,则为非极性分子;
(5)由三种非金属元素形成的荔枝化合物,且含有共价键,应为铵盐,阴、阳离子所含电子数相差8个,应为NH4Cl;
(6)上底面棱上的原子相邻,可以得出长a=2r,内部原子与上底面、及下底面3个原子相邻且均形成正四面体结构,高b为正四面体高的2倍,正四面体的棱长为2r,则正四面体侧面高为2r×$\frac{\sqrt{3}}{2}$=$\sqrt{3}$r,底面中心到边的距离为$\sqrt{3}$r×$\frac{1}{3}$,再利用勾股定理计算正四面体的高.
解答 解:(1)Fe3+的价电子为3d5,根据洪特规则和保利不相容原理,则轨道示意图为 ,故答案为:
,故答案为: ;
;
(2)该元素第六电离能剧增,则元素原子最外层电子数为5,处于VA族,故答案为:VA;
(3)根据价层电子对互斥理论知,若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,若n=2,则分子的立体构型为直线形,若n=3,则分子的立体构型为平面三角形,若n=4,则分子的立体构型为正四面体形,故选:C;
(4)①O2和O3都是由氧元素形成的不同单质,互为同素异形体,故答案为:同素异形体;
②二氧化碳、BeCl2为直线型,水为V形结构,但不存在大π键,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子呈折线形,在三个氧原子之间还存在着一个垂直于分子平面的大π键,这个离域的π键是由中心的氧原子提供两个p电子、另外两个配位氧原子各提供一个p电子形成的,SO2分子呈“V”字形结构,其成键方式与O3类似,S原子sp2杂化,S原子和两侧的氧原子除以σ键结合以外,还形成一个三中心四电子的大π键,故选:C;
③O3中的中心O原子为sp2杂化,理想模型为平面三角形,分子构型为V型,而且O3形成的是三中心四电子大π键,空间构型不对称.正负电荷重心不重合,所以是极性分子,故答案为:是;
(5)由三种非金属元素形成的荔枝化合物,且含有共价键,应为铵盐,阴、阳离子所含电子数相差8个,应为氯化铵,化学式为NH4Cl,电子式为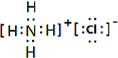 ,故答案为:
,故答案为: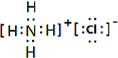 ;
;
(6)上底面棱上的原子相邻,可以得出长a=2r,内部原子与上底面、及下底面3个原子相邻且均形成正四面体结构,高b为正四面体高的2倍,正四面体的棱长为2r,则正四面体侧面高为2r×$\frac{\sqrt{3}}{2}$=$\sqrt{3}$r,底面中心到边的距离为$\sqrt{3}$r×$\frac{1}{3}$,由勾股定理可知正四面体的高为$\sqrt{(\sqrt{3}r)^{2}-(\frac{\sqrt{3}}{3}r)^{2}}$=$\frac{2\sqrt{6}}{3}$r,故b=2×$\frac{2\sqrt{6}}{3}$r=$\frac{4\sqrt{6}}{3}$r,故答案为:2r;$\frac{4\sqrt{6}}{3}$r.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、空间构型、晶胞计算等,需要学生具备一定的空间想象与计算能力,题目难度较大.

| A. | 水 | B. | CuSO4晶体 | C. | 铝片 | D. | 铜片 |
| A. | 质子数c>b | B. | 离子的还原性Z->Y2- | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径X>W |
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2mol NO和1mol O2充分反应,产物的分子数为2NA |
| A. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O═H3O++B2- | |
| B. | 电解饱和食盐水:C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e-═4OH- | |
| D. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| A. | 液态氯化钠、液态氯化氢 | B. | 熔融NaOH、熔融BaSO4 | ||
| C. | 石墨、分析纯盐酸 | D. | 冰醋酸、分析纯硫酸 |
| A. | 稀硫酸 | B. | 稀盐酸 | C. | 硝酸铜 | D. | 氢氧化钠 |
