题目内容
9.25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )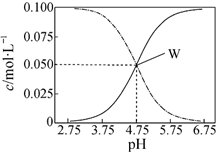
| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) | |
| D. | pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 |
分析 A.由图可知,pH=4.75时,c(CH3COOH)=c(CH3COO-)=0.05mol/L,pH=5.5时,酸性减弱,溶液中c(CH3COOH)降低,溶液中c(CH3COO-)增大,据此确定c(CH3COOH)和c(CH3COO-)的相对大小;
B.由图可知,W点所表示的溶液中c(CH3COOH)=c(CH3COO-)=0.05mol/L,根据W点溶液的pH进行判断;
C.通入0.05molHCl,与溶液中醋酸根恰好反应,溶液中有氢离子剩余,反应后溶液相当于CH3COOH、HCl、NaCl混合溶液,溶液中氢离子源于HCl电离、CH3COOH、水的电离;
D.溶液中c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,根据电荷守恒有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),据此解答.
解答 解:A.pH=5.5比4.75大,W点时c(CH3COOH)=c(CH3COO-),从曲线来看当pH=5.5时,c(CH3COOH)<c(CH3COO-),故A错误;
B.溶液存在电荷守恒,应为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),W点时c(CH3COOH)=c(CH3COO-),而氢离子浓度较小,则c(H+)<<c(CH3COOH),故c(Na+)<c(CH3COO-)+c(CH3COOH),故B错误;
C.通入0.05molHCl,与溶液中醋酸根恰好反应,溶液中有氢离子剩余,反应后溶液相当于CH3COOH、HCl、NaCl混合溶液,溶液中氢离子源于HCl电离、CH3COOH、水的电离,溶液中c(H+)=c(CH3COO-)+c(OH-)+c(HCl),溶液中c(CH3COO-)+c(HCl)≠c(CH3COOH),不可能得出c(H+)=c(CH3COOH)+c(OH-),故C错误;
D.pH=3.5溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.1mol•L-1代入即可得c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1,故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,涉及水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较等知识,溶液中存在水解与电离两个过程的离子浓度大小比较是考试热点内容,学习中要反复加强训练.

| A. | 水 | B. | CuSO4晶体 | C. | 铝片 | D. | 铜片 |
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2mol NO和1mol O2充分反应,产物的分子数为2NA |
| A. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O═H3O++B2- | |
| B. | 电解饱和食盐水:C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e-═4OH- | |
| D. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 增大浓度或使用催化剂均能增大活化分子百分数,增大化学反应速率 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 铬的价电子电子排布式为3d54s1而不是3d44s2是因为半满稳定 |
| A. | 液态氯化钠、液态氯化氢 | B. | 熔融NaOH、熔融BaSO4 | ||
| C. | 石墨、分析纯盐酸 | D. | 冰醋酸、分析纯硫酸 |
| A. | Al2O3用作耐火材料、Al(OH)3用作阻燃剂 | |
| B. | 碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金 | |
| C. | 自然界中不存在游离态的硅,硅主要以二氧化硅和硅酸盐的形式存在 | |
| D. | 通过化学变化可以实现12C与14C间的相互转化 |
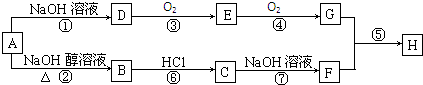
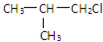 ,G的官能团名称是羧基
,G的官能团名称是羧基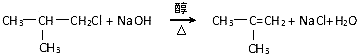 ;E与新制Cu(OH)2反应:
;E与新制Cu(OH)2反应: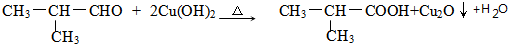 .
.