题目内容
3.pH=4的醋酸和pH=4的氯化铵溶液相比,水的电离程度较大的是( )| A. | 前者 | B. | 后者 | C. | 等于 | D. | 无法确定 |
分析 含有弱根离子的盐能促进水的电离,酸或碱能抑制水的电离,据此分析解答.
解答 解:水的电离方程式为:H20=H++OH-,加入酸或碱后,增大氢离子或氢氧根离子浓度导致水的电离平衡向逆反应方向移动,即抑制水的电离;加入含有弱根离子的盐后,能促进水的电离,所以加入醋酸能抑制水的电离,加入氯化铵能促进水的电离,即氯化铵促进水的电离,故选B.
点评 本题考查了影响水电离的因素,根据“含有弱根离子的盐能促进水的电离,酸或碱能抑制水的电离”就可分析解答本题,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.某烃结构式如下: ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )
 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 有7个碳原子在同一条直线上 | D. | 有5个碳原子在同一直线上 |
14.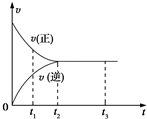 图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
 图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,V(正)>V(逆) | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,各物质的浓度不再发生变化 | D. | t2~t3,反应不再发生 |
18.元素的性质随着原子序数的递增呈现周期性变化的根本原因是( )
| A. | 元素相对原子质量的递增而引起的变化 | |
| B. | 元素的化合价呈周期性的变化 | |
| C. | 元素原子核外电子排布呈周期性的变化 | |
| D. | 元素的金属性和非金属性呈周期性变化 |
15.下列描述中正确的是( )
| A. | CS2为Ⅴ形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中S原子为sp6杂化 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
12.氢氧燃料电池已用于航天飞机.该电池的构造示意图如图,有关说法错误的是( )

| A. | 供电时的总反应为2H2+O2=2H2O | |
| B. | 负极电极反应为2H2+4OH--4e-=4H2O | |
| C. | 正极电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该燃料电池的能量转化率可达100% |



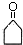 ,G中官能团的名称为酯基、碳碳双键.
,G中官能团的名称为酯基、碳碳双键. +CH3CHO
+CH3CHO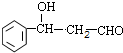 ,反应类型加成反应.
,反应类型加成反应. .
.