题目内容
13.已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151k J、299k J.则由氢气和碘反应生成2mol HI需要放出(填“放出”或“吸收”)11k J的热量.此反应中反应物的总能量大于(填“大于”或“小于”)生成物的总能量.物质具有的能量越低(填”高”或”低”)越稳定.分析 旧键断裂要吸收能量,新键生成要释放能量,当旧键断裂吸收的能量大于新键生成释放的能量时,反应为吸热反应,反应物的总能量小于生成物的总能量;反之则为放热反应,反应物的总能量大于生成物的总能量,物质具有的能量越低越稳定,据此分析.
解答 解:氢气和碘反应生成2molHI是,旧键断裂吸收能量的值为:436kJ+151kJ=587KJ,新键生成释放能量为:299kJ×2=598KJ,旧键断裂吸收的能量小于新键生成释放的能量,反应为放热反应,则此反应中反应物的总能量大于生成物的总能量,物质具有的能量越低越稳定,故答案为:放出;大于;低.
点评 本题主要考查了化学键和键能有关的知识,掌握旧键断裂要吸收能量,新键生成要释放能量是解答的关键,题目难度不大.

练习册系列答案
相关题目
3.pH=4的醋酸和pH=4的氯化铵溶液相比,水的电离程度较大的是( )
| A. | 前者 | B. | 后者 | C. | 等于 | D. | 无法确定 |
1.在同温同压下,下列各组热化学方程式中,Q1>Q2的是( )
| A. | 2H2(g)+O2(g)=2H2O(l);△H=Q1 2H2(g)+O2(g)=2H2O(g)△H=Q2 | |
| B. | S(g)+O2(g)=SO2(g);△H=Q1 S(s)+O2(g)=SO2(g)△H=Q2 | |
| C. | C(s)+0.5O2(g)=CO(g);△H=Q1 C(s)+O2(g)=CO2(g);△H=Q2 | |
| D. | H2(g)+Cl2(g)=2HCl(g);△H=Q1 0.5H2(g)+0.5 Cl2(g)=HCl(g);△H=Q2 |
8.下列元素属于第三周期的是( )
| A. | H | B. | N | C. | Na | D. | K |
18.根据下列事实所作的结论,正确的是( )
| 编号 | 事实 | 结论 |
| A | 甲、乙两种有机物具有相同相对分子质量和不同结构 | 甲和乙一定是同分异构体 |
| B | 质量相同的甲、乙两种烃完全燃烧时产生质量相同的水 | 甲、乙两种分子一定是同分异构体 |
| C | 致冷剂氟里昂(二氯二氟甲烷)不存在同分异构体 | 甲烷分子为正四面体构型 |
| D | 将C2H5Br与NaOH醇溶液共热后的气体直接通入酸性KMnO4溶液,紫红色褪去 | 使KMnO4褪色的一定是C2H4 |
| A. | A | B. | B | C. | C | D. | D |
5.金刚石和石墨是由碳元素组成的两种结构不同的单质(同素异形体).在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能.据此,试判断在100kPa压强下,下列结论正确的是( )
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1 mol石墨比1 mol金刚石的总能量高 | |
| D. | 1 mol石墨与1 mol金刚石的总能量一样高 |
2.尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质.其转化过程如下:
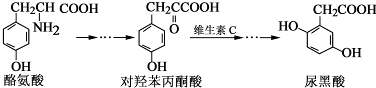
下列说法错误的是( )

下列说法错误的是( )
| A. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| B. | 1 mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 酪氨酸既能与盐酸反应,又能与氢氧化钠反应 | |
| D. | 1 mol尿黑酸与足量NaHCO3反应,最多消耗3 molNaHCO3 |
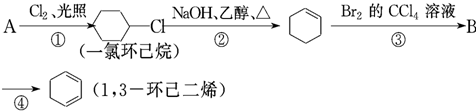
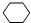
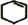 +Br2→
+Br2→ .
. +2NaBr+2H2O.
+2NaBr+2H2O.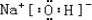 (用电子式表示).
(用电子式表示).