题目内容
12.氢氧燃料电池已用于航天飞机.该电池的构造示意图如图,有关说法错误的是( )
| A. | 供电时的总反应为2H2+O2=2H2O | |
| B. | 负极电极反应为2H2+4OH--4e-=4H2O | |
| C. | 正极电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该燃料电池的能量转化率可达100% |
分析 该燃料电池中,通入燃料氢气的电极是负极、通入氧气的电极是正极,所以a是负极、b是正极,电解质溶液呈碱性,则负极反应式为2H2+4OH--4e-=4H2O、正极电极反应为O2+2H2O+4e-=4OH-,电池反应式为2H2+O2=2H2O,放电过程中,部分化学能转化为热能.
解答 解:A.燃料电池中电池反应式和燃料燃烧方程式相同,所以放电时电池反应式为2H2+O2=2H2O,故A正确;
B.负极上氢气失电子发生氧化反应,和氢氧根离子反应生成水,电极反应式为2H2+4OH--4e-=4H2O,故B正确;
C.正极上氧气得电子发生还原反应,氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故C正确;
D.放电过程中,部分化学能转化为热能等,所以该燃料电池的能量转化率不能达到100%,故D错误;
故选D.
点评 本题考查化学电源新型电池,明确原电池原理是解本题关键,难点是电极反应式的书写,要根据电解质溶液酸碱性酸性,注意碱性条件下电极反应式不能生成氢离子,题目难度不大.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
3.pH=4的醋酸和pH=4的氯化铵溶液相比,水的电离程度较大的是( )
| A. | 前者 | B. | 后者 | C. | 等于 | D. | 无法确定 |
20.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(1)请写出SO2与过量NaOH溶液反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH-和Cl-、SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只存在ClO-.
②要证明假设1是否成立,设计实验方案,进行实验.请在答题卡上写出实验以及预期现象和结论.限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液.
(1)请写出SO2与过量NaOH溶液反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH-和Cl-、SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只存在ClO-.
②要证明假设1是否成立,设计实验方案,进行实验.请在答题卡上写出实验以及预期现象和结论.限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液.
| 实验 | 预期现象和结论 |
在试管加少量的吸收液,再滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,则说明假设1成立,否则假设1不成立 |
17.已知可逆反应2SO2+O2 $?_{△}^{催化剂}$2SO3,当生成2mol SO3时放出热量为Q,现将1mol SO2和0.5mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
| A. | Q1=Q | B. | Q1<Q | C. | 2Q1<Q | D. | 无法判断 |
1.在同温同压下,下列各组热化学方程式中,Q1>Q2的是( )
| A. | 2H2(g)+O2(g)=2H2O(l);△H=Q1 2H2(g)+O2(g)=2H2O(g)△H=Q2 | |
| B. | S(g)+O2(g)=SO2(g);△H=Q1 S(s)+O2(g)=SO2(g)△H=Q2 | |
| C. | C(s)+0.5O2(g)=CO(g);△H=Q1 C(s)+O2(g)=CO2(g);△H=Q2 | |
| D. | H2(g)+Cl2(g)=2HCl(g);△H=Q1 0.5H2(g)+0.5 Cl2(g)=HCl(g);△H=Q2 |
2.尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质.其转化过程如下:
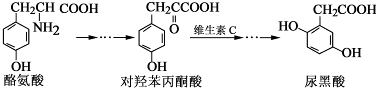
下列说法错误的是( )

下列说法错误的是( )
| A. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| B. | 1 mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 酪氨酸既能与盐酸反应,又能与氢氧化钠反应 | |
| D. | 1 mol尿黑酸与足量NaHCO3反应,最多消耗3 molNaHCO3 |
 (1)乙醇的分子结构如图,其中①②③④⑤表示化学键的代号,用代号回答:
(1)乙醇的分子结构如图,其中①②③④⑤表示化学键的代号,用代号回答:


 +Br2→
+Br2→ .
. +2NaBr+2H2O.
+2NaBr+2H2O.