题目内容
15.下列描述中正确的是( )| A. | CS2为Ⅴ形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中S原子为sp6杂化 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
分析 A.CS2的结构与CO2相似;
B.根据价层电子对数=成键电子数+孤电子数判断;
C.根据价层电子对数=成键电子数+孤电子数判断;
D.根据价层电子对数=成键电子数+孤电子数判断.
解答 解:A.CS2的结构与CO2相似,其结构为S=C=S,属于直线形分子,故A错误;
B.ClO3-中Cl原子的价层电子对数=3+$\frac{1}{2}$(7+1-3×2)=4,含有一个孤电子对,所以为三角锥形,故B错误;
C.SF6中S原子的价层电子对数=6+$\frac{1}{2}$(6-6×1)=6,则S原子为sp3d2杂化,故C错误;
D.SiF4中Si原子的价层电子对数=4+$\frac{1}{2}$(4-4×1)=4,SO32-中S原子的价层电子对数=3+$\frac{1}{2}$(6+2-2×3)=4,则SiF4和SO32-的中心原子均为sp3杂化,故D正确.
故选D.
点评 本题考查了杂化类型的判断、分子构型的判断等,题目难度不大,注意把握价层电子对数的计算方法.

练习册系列答案
相关题目
6.我国于2009年12月1日起实施新的国家强制标准《塑料一次性餐饮具通用技术要求》,其中规定只有完全降解变成CO2或CH4、H2O等物质的一次性餐饮具才能标注为“可降解餐饮具”,这将有利于减少“白色污染”.新型材料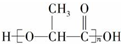 可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )
可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )
 可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )
可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )| A. | 合成该材料的单体为 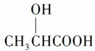 | |
| B. | 该合成材料的单体在氢氧化钠溶液作用下可形成环酯 | |
| C. | 合成该材料的方式与聚苯乙烯不同 | |
| D. | 该材料在一定条件下可发生水解 |
3.pH=4的醋酸和pH=4的氯化铵溶液相比,水的电离程度较大的是( )
| A. | 前者 | B. | 后者 | C. | 等于 | D. | 无法确定 |
10.下列方程式中是某种盐的水解方程式的是( )
| A. | HCO3-+H2O?CO32-+H3O+ | B. | H2O+H2O?H3O++OH- | ||
| C. | CO2+H2O?H2CO3 | D. | CO32-+H2O?HCO3-+OH- |
20.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(1)请写出SO2与过量NaOH溶液反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH-和Cl-、SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只存在ClO-.
②要证明假设1是否成立,设计实验方案,进行实验.请在答题卡上写出实验以及预期现象和结论.限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液.
(1)请写出SO2与过量NaOH溶液反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH-和Cl-、SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只存在ClO-.
②要证明假设1是否成立,设计实验方案,进行实验.请在答题卡上写出实验以及预期现象和结论.限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液.
| 实验 | 预期现象和结论 |
在试管加少量的吸收液,再滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,则说明假设1成立,否则假设1不成立 |
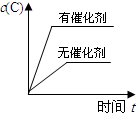
5.金刚石和石墨是由碳元素组成的两种结构不同的单质(同素异形体).在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能.据此,试判断在100kPa压强下,下列结论正确的是( )
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1 mol石墨比1 mol金刚石的总能量高 | |
| D. | 1 mol石墨与1 mol金刚石的总能量一样高 |


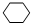
 +Br2→
+Br2→ .
.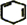 +2NaBr+2H2O.
+2NaBr+2H2O.