题目内容
18.元素的性质随着原子序数的递增呈现周期性变化的根本原因是( )| A. | 元素相对原子质量的递增而引起的变化 | |
| B. | 元素的化合价呈周期性的变化 | |
| C. | 元素原子核外电子排布呈周期性的变化 | |
| D. | 元素的金属性和非金属性呈周期性变化 |
分析 化学反应中,原子最外层电子决定元素的性质,元素周期表中,原子核外电子呈周期性变化,则决定元素的性质呈周期性变化,以此解答该题.
解答 解:元素化学性质随着原子序数的递增呈现周期性变化的原因是原子核外电子排布的周期性变化,原子核外电子排布的周期性变化决定了原子半径的周期性变化、元素化合价的周期性变化、金属性和非金属性的周期性变化,随原子的相对原子质量的递增,元素发生变化,但不能说明周期性变化,只有C符合.
故选C.
点评 本题考查元素周期律的实质,明确原子的结构与性质的关系、元素的性质有哪些是解答的关键,并注意不能用元素本身的性质来解释元素性质的周期性变化.

练习册系列答案
相关题目
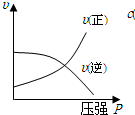
8.设C(S)+CO2(g)?2CO (g)△H>0,反应速度为V1;
N2(g)+3H2(g)?2NH3 (g)△H<0,反应速度为V2,
对于上述反应,当温度升高时,V1和V2的变化情况正确的是( )
N2(g)+3H2(g)?2NH3 (g)△H<0,反应速度为V2,
对于上述反应,当温度升高时,V1和V2的变化情况正确的是( )
| A. | 同时增大 | B. | 同时减小 | C. | 增大,减小 | D. | 减小,增大 |
9.下列各组物质在变化时,所克服的微粒间作用力属于同种类型的是( )
| A. | 金刚石和晶体硫的熔融 | B. | 石墨和食盐的熔化 | ||
| C. | 晶体碘和晶体二氧化碳的升华 | D. | 冰的融化和硝酸钠的熔化 |
6.我国于2009年12月1日起实施新的国家强制标准《塑料一次性餐饮具通用技术要求》,其中规定只有完全降解变成CO2或CH4、H2O等物质的一次性餐饮具才能标注为“可降解餐饮具”,这将有利于减少“白色污染”.新型材料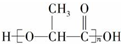 可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )
可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )
 可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )
可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )| A. | 合成该材料的单体为 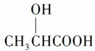 | |
| B. | 该合成材料的单体在氢氧化钠溶液作用下可形成环酯 | |
| C. | 合成该材料的方式与聚苯乙烯不同 | |
| D. | 该材料在一定条件下可发生水解 |
13.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | CO2和SiO2 | B. | AlCl3 和NaOH | C. | 氩和P4 | D. | 金刚石和水晶 |
3.pH=4的醋酸和pH=4的氯化铵溶液相比,水的电离程度较大的是( )
| A. | 前者 | B. | 后者 | C. | 等于 | D. | 无法确定 |
10.下列方程式中是某种盐的水解方程式的是( )
| A. | HCO3-+H2O?CO32-+H3O+ | B. | H2O+H2O?H3O++OH- | ||
| C. | CO2+H2O?H2CO3 | D. | CO32-+H2O?HCO3-+OH- |
8.下列元素属于第三周期的是( )
| A. | H | B. | N | C. | Na | D. | K |