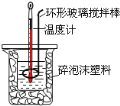
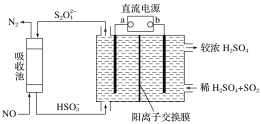
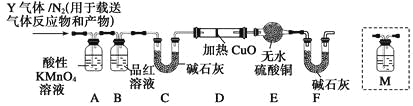
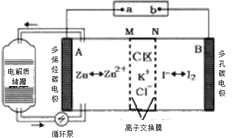
题目内容
【题目】将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解(产生气体全部逸出),冷却后将溶液稀释至1000ml,测得c(H+)=0.84mol/L;若要使稀释后溶液中的Cu2+沉淀完全,应加入6.0mol/L的NaOH溶液的体积为:
A.100mLB.160mLC.240mLD.307mL
【答案】D
【解析】
反应剩余硫酸的物质的量为:![]() ×0.84mol/L×1L=0.42mol,设混合物中含铜、氧化铜的物质的量分别为x、y,则:
×0.84mol/L×1L=0.42mol,设混合物中含铜、氧化铜的物质的量分别为x、y,则:
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
1 2 1
x 2x x
CuO+H2SO4═CuSO4+H2O
1 1
yy
所以,2x+y=18.4mol/L×0.05L-0.42mol=0.5mol,64g/molx+80g/moly=20.8g,解得:x=0.2mol,y=0.1mol,n(SO2)=0.2mol,1000mL溶液中SO42-的总量为18.4mol/L×0.05L-0.2mol=0.72mol,Cu2+刚好沉淀完全,此时溶液中溶质为Na2SO4,根据钠离子守恒n(NaOH)=2n(Na2SO4),故需要n(NaOH)=2n(Na2SO4)=0.72mol×2=1.44mol,所以沉淀Cu2+所需氢氧化钠的体积=![]() =0.24L=240mL,故选C。
=0.24L=240mL,故选C。

练习册系列答案
相关题目