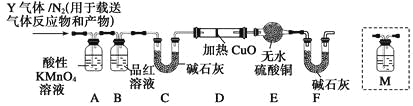
��Ŀ����
����Ŀ��ijѧ��������֪���ʵ���Ũ�ȵ������������ζ��ⶨδ֪���ʵ���Ũ�ȵ�������Һ
��1������ 500ml Ũ��Ϊ 0.1 mol��L ��1 ������������Һ�IJ������������ǣ�������____��ȴ��ת��������ƿ��ϴ�Ӳ�ת___ҡ�ȡ�
��2����ͼ��_____(����������������)�ζ���ʢװ NaOH��Һ��
![]()
��3�����еζ�����ʱ����ѧ����ʵ�鲽�����£�
A��
B��������ˮϴ�ɾ��ζ���
C.��ʽ�ζ����ñ�Һ��ϴ����Һע���ʽ�ζ��̶ܿȡ�0������ 2-3cm �����ٰѼ�ʽ�ζ��̶ܹ��ã�����Һ�����̶ȡ�0����0���̶�����
D.�ô��ⶨ��������Һ��ϴ��ʽ�ζ���
E.����ʽ�ζ���ȡ����HCl��Һ25.00mL��ע����ƿ�У�����2�η�̪��
F������ƿ���ڵζ������棬�ߵα�ҡ����ƿֱ���ζ��յ㣬���µζ���Һ�����ڿ̶�G����ȡ��ƿ�����ظ����� 2 ��
������A�IJ���Ϊ____��������������жϵζ��յ�______
��4�����в����п���ʹ����������Һ��Ũ��ƫ�͵���_____
A����ʽ�ζ���δ�ñ�����������Һ��ϴ��ֱ��ע���Һ
B���ζ������У���Һ�δ���ƿ�н���
C.��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D.��ȡ�����������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
��5��ijѧ����������ʵ��ֱ��¼�й��������£���ѡ�����к��������ݼ����������Һ�����ʵ���Ũ�ȣ�c(HCl) =_________
�ζ����� | ����������Һ����� /ml | �ζ�ǰ�������Ƶ��������/ml | �ζ����������Ƶ��������/ml |
��һ�� | 25.00 | 0.50 | 26.40 |
�ڶ��� | 25.00 | 1.56 | 30.30 |
������ | 25.00 | 0.22 | 26.32 |
���𰸡��ܽ� ���� �� ���ζ����Ƿ�©ˮ �������һ�α�����������Һʱ����ƿ��Һ����ɫ���dz��ɫ���Ұ�����ڱ��ֲ��� BD 0.1040mol/L
��������
��1������ 500ml Ũ��Ϊ0.1 mol��L-1 ������������Һ�IJ������������ǣ��������ܽ⡢��ȴ��ת��������ƿ��ϴ�Ӳ����ݣ�ҡ�ȣ�
��2��ʢװ NaOH��Һ��Ҫ��ʽ�ζ��ܣ�
��3�����еζ�����ʱ����һ��Ҫ���ζ����Ƿ�©ˮ���÷�̪��Ϊָʾ��ʱ���������һ�α�����������Һʱ����ƿ��Һ����ɫ���dz��ɫ���Ұ�����ڱ��ֲ���ʱ������ζ��յ㣻
��5������c�����⣩= ![]() �жϣ�
�жϣ�
��6���������ݵ���Ч�ԣ���ȥ��2�����ݣ�Ȼ�����1��3��ƽ������V���������ƣ�= ![]() mL=26.10mL�����ݷ�Ӧ����ʽ��HCl+NaOH=NaCl+H2O��n��HCl��=n��NaOH��������0.0261L��0.1000mol/L=0.025L��c��HCl�������Խ�á�
mL=26.10mL�����ݷ�Ӧ����ʽ��HCl+NaOH=NaCl+H2O��n��HCl��=n��NaOH��������0.0261L��0.1000mol/L=0.025L��c��HCl�������Խ�á�
��1������ 500ml Ũ��Ϊ 0.1 mol��L ��1 ������������Һ�IJ������������ǣ��������ܽ⡢��ȴ��ת��������ƿ��ϴ�Ӳ����ݣ�ҡ�ȡ��ʴ��ǣ��ܽ⣻���ݣ�
��2��ʢװ NaOH��Һ��Ҫ��ʽ�ζ��ܣ���ѡ�ң�
��3�����еζ�����ʱ����һ��Ҫ���ζ����Ƿ�©ˮ���÷�̪��Ϊָʾ��ʱ���������һ�α�����������Һʱ����ƿ��Һ����ɫ���dz��ɫ���Ұ�����ڱ��ֲ���ʱ������ζ��յ㣻
��5��A. ��ʽ�ζ���δ�ñ�����������Һ��ϴ��ֱ��ע�������������Һ����Һ��Ũ��ƫС�����V������ƫ����c�����⣩= ![]() ��֪���ⶨc��NaOH��ƫ��A����
��֪���ⶨc��NaOH��ƫ��A����
B. �ζ������У���Һ�δ���ƿ�н��������V������ƫС������c�����⣩= ![]() ��֪���ⶨc��NaOH��ƫС����B��ȷ��
��֪���ⶨc��NaOH��ƫС����B��ȷ��
C. ��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ�����V������ƫ����c�����⣩= ![]() ��֪���ⶨc��NaOH��ƫ��C����
��֪���ⶨc��NaOH��ƫ��C����
D. ��ȡ�����������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ��������V������ƫС������c�����⣩= ![]() ��֪���ⶨc��NaOH��ƫС����D��ȷ��
��֪���ⶨc��NaOH��ƫС����D��ȷ��
��ȷ����BD��
��6���������ݵ���Ч�ԣ���ȥ��2�����ݣ�Ȼ�����1��3��ƽ������V���������ƣ�= ![]() mL=26.10mL�����ݷ�Ӧ����ʽ��HCl+NaOH=NaCl+H2O��n��HCl��=n��NaOH��������0.0261L��0.1000mol/L=0.025L��c��HCl�������c��HCl��=
mL=26.10mL�����ݷ�Ӧ����ʽ��HCl+NaOH=NaCl+H2O��n��HCl��=n��NaOH��������0.0261L��0.1000mol/L=0.025L��c��HCl�������c��HCl��= ![]() =0.1044mol/L���ʴ�Ϊ��0.1044mol/L��
=0.1044mol/L���ʴ�Ϊ��0.1044mol/L��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�