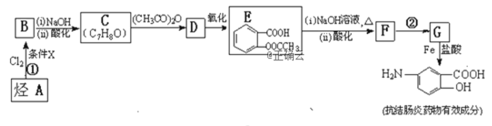
题目内容
【题目】硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为_____________。
(2)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因_____。
II.晶体的制备。将上述制备的CuSO4溶液按如图所示进行操作
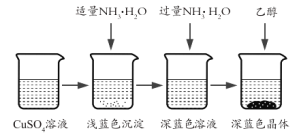
(3)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式___________。
(4)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是_______________。
III.氨含量的测定。精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mLClmol/L的盐酸标准溶液完全吸收。取下接收瓶,用C2mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。
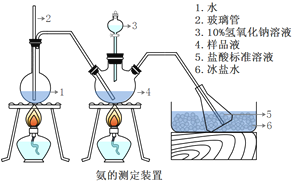
(5)玻璃管2的作用_________________,样品中氨的质量分数的表达式_______。
(6)下列实验操作可能使氨含量测定结果偏低的原因是______________。
A.滴定时未用NaOH标准溶液润洗滴定管
B.读数时,滴定前平视,滴定后俯视
C.滴定过程中选用酚酞作指示剂
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁
【答案】坩埚 反应中硫酸过量,在浓缩过程中,稀硫酸逐渐变浓,浓硫酸的吸水性使![]() 失水变成
失水变成![]()
![]() 硫酸四氨合铜晶体容易受热分解 平衡气压,防止堵塞和倒吸
硫酸四氨合铜晶体容易受热分解 平衡气压,防止堵塞和倒吸 ![]() AC
AC
【解析】
Ⅰ.(1)灼烧固体,应在坩埚中进行;
(2)得到的为硫酸铜和硫酸溶液,浓缩时,硫酸变浓,具有吸水性;
Ⅱ.CuSO4溶液加入氨水,先生成Cu2(OH)2SO4沉淀,氨水过量,反应生成Cu[(NH3)4]SO4·H2O,用乙醇洗涤,可得到晶体。
Ⅰ.(1)灼烧固体,应在坩埚中进行;
(2)得到的为硫酸铜和硫酸溶液,浓缩时,硫酸变浓,浓硫酸具有吸水性,使CuSO4·5H2O失去结晶水变为CuSO4,可使固体变为白色;
Ⅱ.(3)浅蓝色沉淀的成分为Cu2(OH)2SO4,反应的离子方程式为2Cu2++2NH3·H2O+SO42-=Cu2(OH)2SO4+2NH4+;
(4)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是Cu[(NH3)4]SO4·H2O晶体容易受热分解;
Ⅲ.(5)装置中长导管可平衡烧瓶内部和外界的气压,可以防止堵塞和倒吸,与氨气反应的n(HCl)=10-3V1L×c1mol·L-1-c2×10-3V2L=10-3(c1V1-c2V2)mol,根据氨气和HCl的关系式知,n(NH3)=n(HCl)= 10-3(c1V1-c2V2)mol,则样品中氨的质量分数为![]() ;
;
6)根据氨的质量分数的表示式,若氨含量测定结果偏高,则V2偏小;
A.滴定时未用NaOH标准溶液润洗滴定管,浓度偏低,则V2偏大,含量偏低,A符合题意;
B.读数时,滴定前平视,滴定后俯视,导致V2偏小,则含量偏高,B不符合题意;
C.滴定过程中选用酚酞作指示剂,滴定终点的溶液中含有NH4Cl和NaCl,溶液呈酸性,
如果使用酚酞作指示剂,消耗的NaOH增大,则V2偏大,结果偏低,C符合题意;
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁,部分盐酸没有反应,需要的氢氧化钠偏少,则V2偏小,含量偏高,D不符合题意。
答案为AC。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
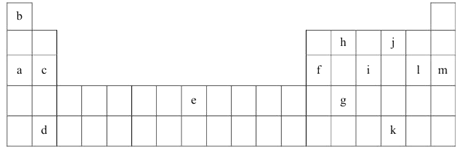
(1)上述元素的单质可能是电的良导体的是_______(填字母代号)。
(2)下表是一些气态原子的第一、二、三、四级电离能(kJ·mol-1):
锂 | X | Y | |
第一电离能 | 519 | 502 | 580 |
第二电离能 | 7296 | 4570 | 1820 |
第三电离能 | 11799 | 6920 | 2750 |
第四电离能 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:______________________________________。
②表中的Y可能为以上13种元素中的_________(填元素符号)元素,用元素符号表示X和j按原子个数1:1形成化合物的电子式___________________________。
(3)根据构造原理,用电子排布式表示e的核外电子排布式_______________。
(4)以上13种元素中,________(填元素符号)元素原子失去核外第一个电子需要的能量最多。
(5)a、e、f三种元素的最高价氧化物的水化物显碱性,其碱性最强的为_______(用化学符号作答)。f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式___________________。