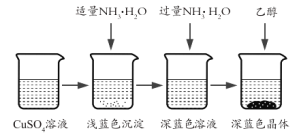
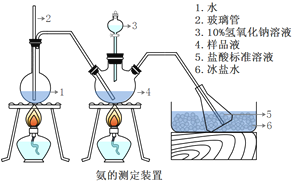
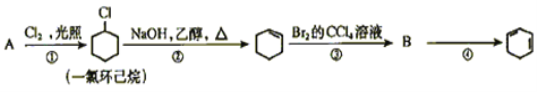
题目内容
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于______(填写“六方”、“面心立方”或“体心立方”)。
(2)B-的电子排布式为____________,在CB3分子中C元素原子的原子轨道发生的是___________杂化。
(3)C的氢化物的空间构型为____________________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是________________________。
(4)B元素的电负性_______D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明___________。
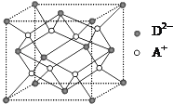
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为_______。(阿伏加德罗常数用NA表示)
【答案】体心立方 ls22s22p63s23p6 sp3 三角锥形 氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高 > H2S+Cl2=2HCl+S↓ ![]()
【解析】
B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;B-离子为Cl-。A+比B-少一个电子层,A+为Na+;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为ns2np3,是第ⅤA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第ⅥA族元素,最高价氧化物中含D的质量分数为40%,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素,A+是Na+,D2-是S2-,R是由Na+与S2-以2:1形成的离子化合物,R是Na2S。
(1)Na形成的晶体采用A2密堆积型式,则其晶胞类型应属于体心立方;
(2)B-为Cl-,电子排布式为ls22s22p63s23p6,CB3分子为NCl3分子,N原子有一对孤对电子,与Cl原子成3个σ键,杂化轨道数为1+3=4,所以为sp3杂化;
(3)C的氢化物为NH3,N原子采取sp3杂化,N原子有一对孤对电子,所以NH3的空间构型为三角锥形;N原子电负性很强,氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高;
(4)B为Cl元素,D为S元素,同周期,自左而右,电负性增强,所以电负性Cl>S.利用“在氧化还原反应中,氧化剂氧化性大于氧化产物”原理,一般来说电负性越强,元素的非金属性越强,对应的单质的氧化性越强,如在H2S+Cl2=2HCl+S↓;
(5)A+是Na+,D2-是S2-,根据均摊法计算。在顶点和面心具有S2-,则晶胞含有![]() ,晶胞中的8个Na+均为晶胞所有。则有
,晶胞中的8个Na+均为晶胞所有。则有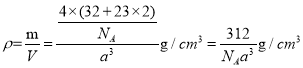 。
。

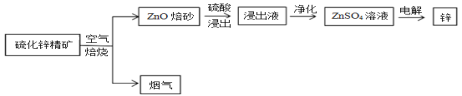
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:

(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。

① 溶液a呈酸性,原因是______。
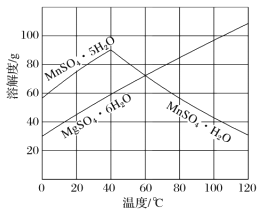
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。