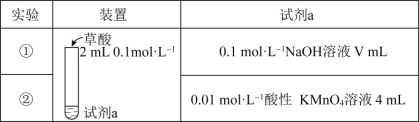题目内容
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法不正确的是( )
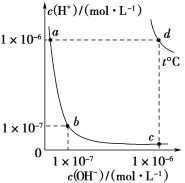
A.d点对应的食盐水pH=6,呈中性
B.a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
C.温度为t ℃时,0.05 mol·L-1 Ba(OH)2溶液的pH=11
D.向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
【答案】B
【解析】
A. 由图可知d点水的离子积Kw=10-6×10-6=10-12,据此分析判断;
B. 酸对水的电离由抑制作用,盐的水解对水的电离有促进作用;
C. 温度为t ℃时,0.05 mol·L-1 Ba(OH)2溶液中c(OH-)=0.05mol/L×2=0.1mol/L,根据c(H+)=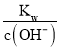 和pH=-lgc(H+)进行计算;
和pH=-lgc(H+)进行计算;
D. 向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,所得溶液c(H+)=c(OH-),显中性。
A. 由图可知d点水的离子积Kw=10-6×10-6=10-12,c(H+)=c(OH-),因此当pH=6时,食盐水呈中性,A项正确,不符合题意;
B. 酸对水的电离由抑制作用,盐的水解对水的电离有促进作用,因此a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度不相同,B项错误,符合题意;
C. 温度为t ℃时,0.05 mol·L-1 Ba(OH)2溶液中c(OH-)=0.05mol/L×2=0.1mol/L,根据c(H+)=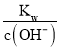 =
=![]() =10-11mol/L,pH=-lgc(H+)=11,C项正确,不符合题意;
=10-11mol/L,pH=-lgc(H+)=11,C项正确,不符合题意;
D. 向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,所得溶液c(H+)=c(OH-),显中性,根据电荷守恒有c(H+)+c(Na+)=c(OH-)+c(CH3COO-),因此c(Na+)=c(CH3COO-),D项正确,不符合题意;
答案选B。