题目内容
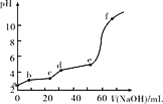
【题目】探究草酸(H2C2O4)的性质,室温下进行以下两组实验:(已知:室温下,H2C2O4的电离平衡常数Ka1=5.0×10-2,Ka2=5.4×10-5)
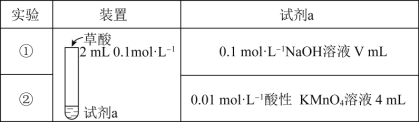
下列有关实验说法正确的是( )
A.若实验①中V=2,则混合后溶液中:c(C2O42-)>c(H2C2O4)
B.若实验①中V=4,则混合后溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
C.实验②反应的离子方程式为5C2O42-+16H++2MnO4-=2Mn2++10CO2↑+8H2O
D.若实验②测得KMnO4溶液的褪色时间为40s,则这段时间内的平均反应速率v(KMnO4)=2.5×10-4molL-1s-1
【答案】A
【解析】
A. 若实验![]() 中
中![]() ,发生H2C2O4+NaOH=NaHC2O4+H2O,溶质为
,发生H2C2O4+NaOH=NaHC2O4+H2O,溶质为![]() 溶液,对于
溶液,对于![]() ,
,![]() ,电离为主,则
,电离为主,则![]() ,故A正确;
,故A正确;
B. 若实验![]() 中
中![]() ,发生H2C2O4+2NaOH=Na2C2O4+2H2O,溶质为
,发生H2C2O4+2NaOH=Na2C2O4+2H2O,溶质为![]() 溶液,根据质子守恒有
溶液,根据质子守恒有![]() ,故B错误;
,故B错误;
C. 草酸不是强酸不能拆,故C错误;
D. 忽略体积变化,V(KMnO4)=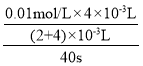 =1.6×10-4mol/(L·s),故D错误;
=1.6×10-4mol/(L·s),故D错误;
答案:A。

练习册系列答案
相关题目