题目内容
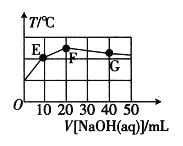
【题目】某温度时,AgCl(s)![]() Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.d点没有AgCl沉淀生成
B.c点对应的Ksp等于a点对应的Ksp
C.加入AgNO3,可以使溶液由c点变到d点
D.加入少量水,平衡右移,Cl-浓度减小
【答案】B
【解析】
A. d点处Ag+浓度大,此时Ag+浓度和Cl-浓度的乘积大于溶度积
B. 温度一定,溶度积不变;
C. 加入AgNO3,c(Ag+)增大,c(Cl-)减小;
D. 加入少量水促进了沉淀的溶解,溶液仍为饱和溶液。
A. d点处Ag+浓度大,此时Ag+浓度和Cl-浓度的乘积大于溶度积,有AgCl沉淀生成,A项错误;
B. 温度一定,溶度积不变,a、c点所处的温度相同,因此 Ksp相同,B项正确;
C. 加入AgNO3,c(Ag+)增大,c(Cl-)减小,而c、d点c(Cl-)相同,C项错误;
D. 加入少量水促进了沉淀的溶解,溶液仍为饱和溶液,c(Cl-)不变,D项错误
答案选B。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】Ⅰ.某小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:
①氨的测定:精确称取wgX,加适量水溶解,注入圆底烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mL c1mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不在消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)用NaOH标准溶液滴定过剩的HCl时,应使用___式滴定管,该滴定实验可使用的指示剂为___,达到滴定终点的现象为___。
(2)样品中氨的质量分数表达式为___。
(3)滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1 ,c(CrO42-)为___mol·L-1。(已知:Ksp(Ag2CrO4)=1.12×10-12)。
Ⅱ.已知
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
(4)则用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为___加入___调节pH为___(保留两位有效数字),铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。
【题目】下列实验方案中,可以达到实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 检验亚硫酸钠是否变质 | 先将亚硫酸钠样品溶于水配成溶液,然后加入足量稀盐酸酸化,再加入 |
B | 除去苯中混有的苯酚 | 加入适量的溴水,充分反应后过滤,弃去沉淀 |
C | 除去NaCl晶体中混有 | 先将晶体溶于水配成溶液,然后蒸发结晶并趁热过滤弃去滤液 |
D | 检验 | 将 |
A.AB.BC.CD.D