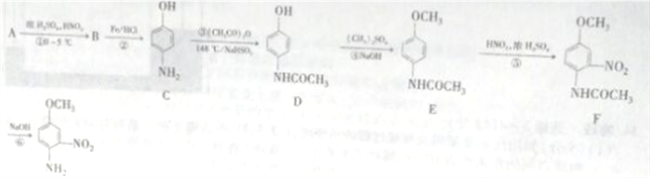
题目内容
【题目】在25℃、1.01×105Pa下,将33gCO2通入到1000ml1.0mol·L-1的NaOH溶液中充分反应,放出xkJ热量。在该条件下1molCO2通入到2L1.0mol·L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为
A. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJmol-1
B. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(4x-y)kJmol-1
C. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-1/2(4x-y)kJmol-1
D. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(8x-2y)kJmol-1
【答案】C
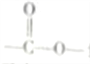
【解析】根据题意,33gCO2通入1molL-1NaOH溶液750mL中充分反应,n(CO2)=![]() =0.75mol,n(NaOH)=1molL-1×1.0L=1mol,该反应既生成碳酸钠又生成碳酸氢钠,方程式为3CO2+4NaOH═2NaHCO3+Na2CO3+H2O,由0.75molCO2反应放出热量为xKJ,则3molCO2反应放出热量为4xKJ,即热化学反应方程式为3CO2(g)+4NaOH(aq)═2NaHCO3(aq)+Na2CO3(aq)+H2O(l)△H=-4xKJ/mol①,又1molCO2通入1molL-1NaOH溶液2L中充分反应放出ykJ的热量,则热化学方程式为2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-yKJ/mol②,由盖斯定律可知,①-②可得,2NaOH(aq)+2CO2(g)═2NaHCO3(aq)△H=-(4x-y)KJ/mol,因此CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-1/2(4x-y)kJmol-1,故选C。
=0.75mol,n(NaOH)=1molL-1×1.0L=1mol,该反应既生成碳酸钠又生成碳酸氢钠,方程式为3CO2+4NaOH═2NaHCO3+Na2CO3+H2O,由0.75molCO2反应放出热量为xKJ,则3molCO2反应放出热量为4xKJ,即热化学反应方程式为3CO2(g)+4NaOH(aq)═2NaHCO3(aq)+Na2CO3(aq)+H2O(l)△H=-4xKJ/mol①,又1molCO2通入1molL-1NaOH溶液2L中充分反应放出ykJ的热量,则热化学方程式为2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-yKJ/mol②,由盖斯定律可知,①-②可得,2NaOH(aq)+2CO2(g)═2NaHCO3(aq)△H=-(4x-y)KJ/mol,因此CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-1/2(4x-y)kJmol-1,故选C。

 阅读快车系列答案
阅读快车系列答案