题目内容
【题目】某组同学为探究草酸浓度对该反应速率的影响,设计下列对照实验:
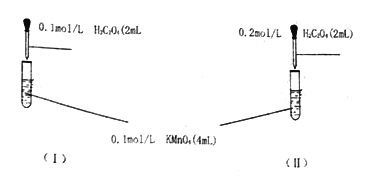
(1)写出上述反应的离子方程式____________。
(2)根据所学知识,你预期的实验现象是:_______(填“l”或“Ⅱ”)中紫色先褪去
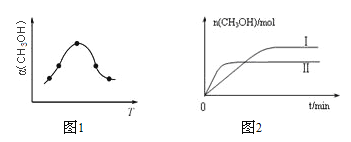
(3)实验时,他们发现反应速率的变化从开始后的一段时间内,变化趋势如图,已知反应过程中温度基本不变,分析:
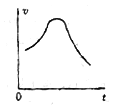
① 反应开始时,速度加块的原因为________;
② 后期反应速度下降的原因为________。
【答案】 2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O Ⅱ 反应生成Mn2+起到催化剂作用,使反应速率加快 随着反应物浓度的下降,反应速率减慢
【解析】(1)酸性高锰酸钾溶液能氧化草酸生成CO2,根据电子守恒、电荷守恒及原子守恒得此反应的离子方程式2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
(2)两个试管中酸性高锰酸钾溶液浓度相等,但Ⅱ中草酸浓度比I中大,浓度大反应速率快,故预期的实验现象是Ⅱ中紫色先褪去;
(3)① 反应开始时,因反应生成Mn2+起到催化剂作用,使反应速率加快 ;
② 随着反应物浓度的下降,浓度对反应速率的影响起决定因素,则后期反应速率减慢。

【题目】铁及其化合物在工业上有许多用途。回答下列有关问题:
(1) FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________。
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g) ![]() CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入到压强为P0的恒压密闭容器中,测得不同时间CO的体积分数![]() (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当______不再发生变化时(写出一条即可),则表明CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____(已知:气体分压=气体总压×体积分数)。
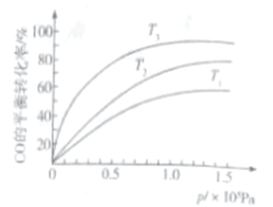
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________。