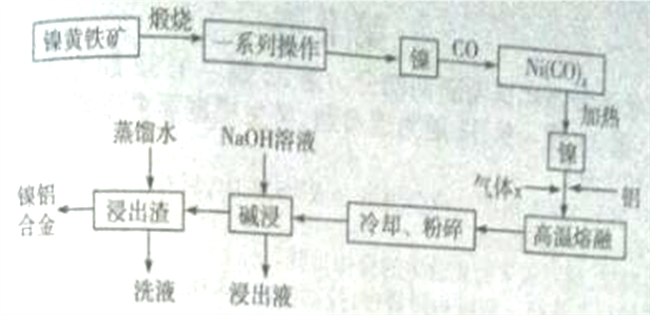
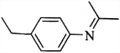
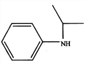
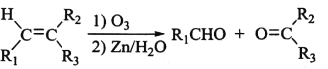题目内容
【题目】4-氨基-3硝基苯甲醚是合成类风湿关节炎治疗药物艾拉莫德的主要原料。4-氨基-3-硝基苯甲醚的合成路线如下:
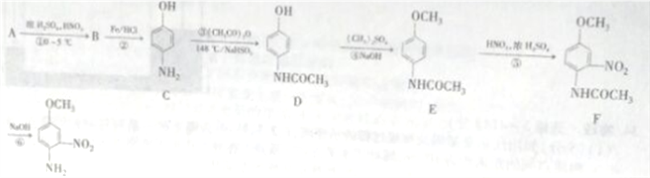
已知: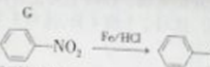 NH2(有弱碱性,易被氧化)
NH2(有弱碱性,易被氧化)
回答下列问题:
(1)A的结构简式为_______________,B的名称是_______________。
(2)反应②的反应类型是____________。
(3)C中官能团的名称是_________________。
(4)写出反应③的化学方程式:________________,反应③温度较高,若不加NaHSO3会导致反应混合体系的颜色明显不同,可能的原因是________________。
(5)写出反应⑥的化学方程式:______________________。
(6)H是E的同分异构体,则满足下列条件的结构有____种(不考虑立体异构),其中核磁共振氢谱中有4组峰,且峰面积比为1:2:2:6的结构简式为_____________。
①含有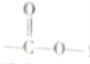 结构且能发生银镜反应
结构且能发生银镜反应
②N原子直接与苯环相连,且结构中不存在N—O键;
③苯环上有两个取代基。
【答案】 ![]() 对硝基苯酚 还原反应 (酚)烃基、氨基
对硝基苯酚 还原反应 (酚)烃基、氨基  酚易被空气中的氧气氧化,加入NaHSO3可防止酚氧化
酚易被空气中的氧气氧化,加入NaHSO3可防止酚氧化  18
18 
【解析】本题考查有机物推断,从官能团的性质入手,(1)A→B,条件是浓硫酸和浓硝酸,A生成B发生硝化反应,根据C的结构简式,溴原子引入到羟基对位,则A的结构简式为:![]() ,B的结构简式为:
,B的结构简式为:![]() ,名称为对硝基苯酚;(2)反应B和C的结构简式对比,发生还原反应;(3)根据C的结构简式,含有官能团是氨基、羟基;(4)根据C和D的结构简式,CH3CO-取代-NH2上一个氢原子,反应方程式为:
,名称为对硝基苯酚;(2)反应B和C的结构简式对比,发生还原反应;(3)根据C的结构简式,含有官能团是氨基、羟基;(4)根据C和D的结构简式,CH3CO-取代-NH2上一个氢原子,反应方程式为: ,酚羟基容易被氧气氧化,因此温度较高,不加NaHSO3,造成酚易被空气中的氧气氧化,加入NaHSO3可防止酚氧化;(5) 根据F和G的结构简式,反应方程式为:
,酚羟基容易被氧气氧化,因此温度较高,不加NaHSO3,造成酚易被空气中的氧气氧化,加入NaHSO3可防止酚氧化;(5) 根据F和G的结构简式,反应方程式为: ;(6)属于甲酸某酯,
;(6)属于甲酸某酯, (邻、间、对三种)、
(邻、间、对三种)、 (邻、间、对三种)、
(邻、间、对三种)、 (邻、间、对三种)、
(邻、间、对三种)、 (邻、间、对三种)、
(邻、间、对三种)、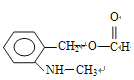 (邻、间、对三种),共有3×5=15种,符合信息的结构简式
(邻、间、对三种),共有3×5=15种,符合信息的结构简式 。
。

【题目】铁及其化合物在工业上有许多用途。回答下列有关问题:
(1) FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________。
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g) ![]() CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入到压强为P0的恒压密闭容器中,测得不同时间CO的体积分数![]() (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当______不再发生变化时(写出一条即可),则表明CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____(已知:气体分压=气体总压×体积分数)。
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________。