题目内容
10.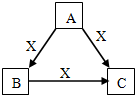 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如右图.请针对以下三种情况不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如右图.请针对以下三种情况不同情况回答:(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得到B的白色胶状沉淀,该沉淀可用于净水.
①A中含有的金属元素在元素周期表中的位置为第三周期IIIA族,向水中加入X
物质,X对水的电离平衡的影响是抑制(填“促进”、“抑制”或“无影响”).
②A与C的水溶液混合后产生B的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3.
(2)若A为固态非金属单质,其一种单质在空气中易自燃;A与X同周期,同时A在X单质中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构.
①若A为该元素的白色固体单质,则1molA单质中含共价键数目为6NA,已知31gA完全燃烧放出akJ热量,则表示A的燃烧热的化学方程式为P4(s)+5O2(g)=2P2O5(s)△H=-4akJ/mol.
②X与水反应的离子方程式为Cl2+H2O=H++Cl-+HClO.
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物.
①A中所含化学键类型为离子键、共价键.
②B溶液中离子浓度由小到大的顺序是c(H+)<c(HCO3-)<c(OH-)<c(CO32-)<c(Na+).
分析 A、B、C、X是中学化学常见物质,均由短周期元素组成.
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠;
①A中含有的金属元素为Al;加入X为氢氧化钠,抑制水的电离程度;
②A与C的水溶液混合后生成B,是铝离子和偏铝酸根离子双水解反应生成氢氧化铝沉淀;
(2)①若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构,同时A在X中燃烧,由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,x为氯气;依据磷单质分子式为P4分析共价键数,三氯化磷是共价化合物,写出电子式;
②X与水反应是氯气和水反应生成盐酸和次氯酸,次氯酸是弱电解质;
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳;
①A为氢氧化钠使钠离子和氢氧根离子构成,据此分析化学键类型;
②C为NaHCO3,碳酸氢根离子水解大于电离,溶液呈碱性
解答 解:(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠.
①A、B、C中含有的同一种常见金属元素为Al,在周期表中位置是第三周期,ⅢA族,向水中加入X氢氧化钠是碱,对水的电离平衡的影响是抑制;
故答案为:第三周期IIIA族;抑制;
②A的水溶液含有铝离子,C水溶液含有偏铝酸根,混合反应生成氢氧化铝沉淀,反应离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3;
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3;
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构,由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,x为氯气.
①若A为该元素的白色固体单质,则A为白磷,分子式为P4,所以1molA单质中含共价键数目为6NA,已知31g(即0.25mol)白磷完全燃烧放出akJ热量,则表示白磷的燃烧热的化学方程式为P4(s)+5O2(g)=2P2O5(s)△H=-4akJ/mol,
故答案为:6;P4(s)+5O2(g)=2P2O5(s)△H=-4akJ/mol;
②X为Cl2,与水反应,生成次氯酸和盐酸,反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,
故答案为:Cl2+H2O=H++Cl-+HClO;
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳.
①A为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,属于A中所含有的化学键是 离子键、共价键,
故答案为:离子键、共价键;
②B为碳酸钠,溶液中碳酸根离子水解,一级水解大于二级水解,溶液呈碱性,溶液中离子浓度由小到大的顺序是:c(H+)<c(HCO3-)<c(OH-)<c(CO32-)<c(Na+),
故答案为:c(H+)<c(HCO3-)<c(OH-)<c(CO32-)<c(Na+).
点评 本题考查元素化合物性质和转化关系推断,难度中等,关键掌握常见元素化合物的性质,根据转化关系选择合适的物质进行解答.

 名校课堂系列答案
名校课堂系列答案| A. | 可吸入颗粒物(PM10) | B. | NO2浓度 | ||
| C. | SO2浓度 | D. | CO2浓度 |
| A. | 用苯萃取碘水中的碘单质 | |
| B. | 用分液漏斗分离水与乙酸乙酯的混合物 | |
| C. | 用酸性高锰酸钾溶液除去甲烷中混有的少量乙烯,以获得纯净的甲烷 | |
| D. | 常温下,将铁片浸入浓硫酸中片刻,取出洗净,再浸入CuSO4溶液中,无现象,能证明铁被浓硫酸钝化 |
| A. | 12g金刚石晶体中含有的C-C的数目为2NA | |
| B. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA | |
| D. | 标准状况下,22gCO2气体中含有的σ键和π键的数目均为2NA |
| A. | 制备乙酸乙酯时可用热的NaOH代替饱和NaHCO3溶液来除去其中的乙酸 | |
| B. | SO2使酸性KMnO4溶液褪色与乙烯使溴水褪色的原理相同 | |
| C. | 可用CuSO4溶液除去制乙炔时混有的杂质H2S | |
| D. | 在AgI饱和溶液中加入KCl固体可产生白色沉淀,说明Ksp(AgCl)<Ksp(AgI) |
| A. | 钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂 | |
| B. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| C. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污渍 | |
| D. | 高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸 |