题目内容
15.下列表述正确的是( )| A. | 钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂 | |
| B. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| C. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污渍 | |
| D. | 高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸 |
分析 A、钠钾合金呈液态,可以做中子反应堆作热交换剂;
B、氯化钠溶液与铝制容器可以构成原电池,金属铝作负极,发生电化学腐蚀;
C、碱不能除去烃类化合物;
D、纯碱和石英砂制玻璃,利用难挥发性酸酐制备易挥发性酸酐,碳酸酸性大于硅酸.
解答 解:A、钠钾合金呈液态,具有良好的导热、导电性质,可以做中子反应堆作热交换剂,故A正确;
B、氯化钠溶液与铝制容器可以构成原电池,金属铝作负极,发生电化学腐蚀,加快铝腐蚀,故B错误;
C、矿物油渍属于烃类化合物,碱和烃类化合物不反应,所以不能用纯碱除去矿物油渍,故C错误;
D、纯碱和石英砂制玻璃,SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,利用难挥发性酸酐制备易挥发性酸酐,实际碳酸酸性大于硅酸,故D错误;
故选A.
点评 本题考查较综合,涉及元素化合物性质的综合考查,注重基础知识的考查,题目难度不大.注意C中矿物油渍和植物油油渍的区别.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
6.化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
| A. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| B. | 新型生物柴油和矿物油主要化学成分相同 | |
| C. | “洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳 | |
| D. | 用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 |
3.用NA表示阿伏加德罗常数,下列说法错误的是( )
| A. | 1L0.1mol/L NaHCO3溶液中含有0.1NA个HCO${\;}_{3}^{-}$ | |
| B. | 78gNa2O2与足量CO2反应,转移电子数为NA | |
| C. | 100℃时,1L pH=1的硫酸溶液中,含有0.05NA个SO42- | |
| D. | 常温常压下,4g CH4含NA个共价键 |
20.下列有关溶液中微粒浓度关系的叙述错误的是( )
| A. | 0.1 mol•L-1 KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-) | |
| B. | pH相等的①CH3COONa、②C6H5ONa、③Na2CO3、④NaOH四种溶液的物质的量浓度大小:①>②>③>④ | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 向0.1 mol•L-1 NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
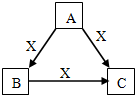 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如右图.请针对以下三种情况不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如右图.请针对以下三种情况不同情况回答: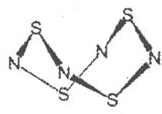
 A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素,其中A中含有5个原子核,它们之间有如下的反应关系.
A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素,其中A中含有5个原子核,它们之间有如下的反应关系. 、D
、D .
.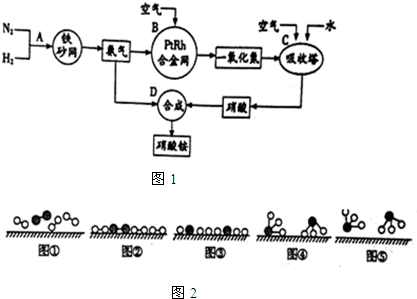
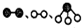 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂.