题目内容
1.下列实验方法不能达到实验目的是( )| A. | 用苯萃取碘水中的碘单质 | |
| B. | 用分液漏斗分离水与乙酸乙酯的混合物 | |
| C. | 用酸性高锰酸钾溶液除去甲烷中混有的少量乙烯,以获得纯净的甲烷 | |
| D. | 常温下,将铁片浸入浓硫酸中片刻,取出洗净,再浸入CuSO4溶液中,无现象,能证明铁被浓硫酸钝化 |
分析 A.萃取剂不能和原溶剂互溶,且溶质在萃取剂中溶解度大于在原溶剂中溶解度,萃取剂和溶质不反应;
B.互不相溶的液体可以采用分液方法分离;
C.乙烯被酸性高锰酸钾氧化生成二氧化碳;
D.常温下,铁和浓硫酸发生钝化现象.
解答 解:A.碘在苯中的溶解度大于在水中的溶解度,苯和水不互溶,苯和碘不反应,所以苯可以作萃取剂,故A正确;
B.水和乙酸乙酯不互溶,所以可以采用分液方法分离,故B正确;
C.乙烯被酸性高锰酸钾氧化生成二氧化碳,除去杂质又引进新的杂质,可以用溴水除去甲烷中乙烯,故C错误;
D.常温下,将铁片浸入浓硫酸中片刻,取出洗净,再浸入CuSO4溶液中,无现象,说明Fe和浓硫酸发生反应导致铁性质发生变化,该现象是钝化现象,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高考高频点,涉及物质的分离和提纯、钝化等知识点,明确实验原理是解本题关键,会根据物质的性质采取合适的方法分离、提纯物质,题目难度中等.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
12.下列关于物质性质的说法正确的是( )
| A. | 通常状况下,NO2是无色的气体 | |
| B. | SO2能漂白品红等物质,说明SO2有氧化性 | |
| C. | 加热时,铁单质与浓硝酸不发生反应 | |
| D. | 二氧化氯具有强氧化性,可用于自来水的杀菌消毒 |
9.下列过程不属于化学变化的是( )
| A. | 石油裂解 | B. | 工业制钠 | C. | 蛋白质的盐析 | D. | 煤的液化 |
16.反应2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O可制备高效消毒剂ClO2.对于该反应,下列说法正确的是( )
| A. | H2SO4是氧化剂 | B. | NaClO3被氧化 | C. | ClO2是氧化产物 | D. | Na2SO3是还原剂 |
6.化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
| A. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| B. | 新型生物柴油和矿物油主要化学成分相同 | |
| C. | “洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳 | |
| D. | 用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 |

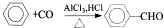
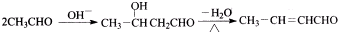
 .
.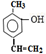 .
. 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题: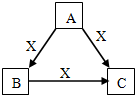 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如右图.请针对以下三种情况不同情况回答:
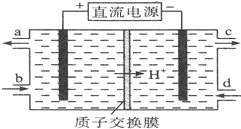
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如右图.请针对以下三种情况不同情况回答: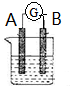 如图所示为原电池装置示意图.
如图所示为原电池装置示意图.