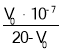题目内容
【题目】某课外活动小组做了如下关于钠的探究实验。
探究一:钠与水反应
![]() 该反应的离子方程式_______________________________。
该反应的离子方程式_______________________________。
![]() 用如图所示的实验装置可以进行钠与水反应的实验,并可收集、检验生成的气体,煤油的密度为
用如图所示的实验装置可以进行钠与水反应的实验,并可收集、检验生成的气体,煤油的密度为![]() 液体物质添加完毕后,关闭活塞A,向煤油中加入一小块钠,立即塞好胶塞,反应开始前钠的位置在______处(填“a”、“b”或“c”)。
液体物质添加完毕后,关闭活塞A,向煤油中加入一小块钠,立即塞好胶塞,反应开始前钠的位置在______处(填“a”、“b”或“c”)。

![]() 若实验室要配制480mL0.
若实验室要配制480mL0.![]() NaOH溶液。
NaOH溶液。
①需______gNaOH。
②配制过程中,所用的玻璃仪器除玻璃棒、容量瓶、胶头滴管外,还有______。
③列操作会使所配NaOH溶液浓度偏小的是______(填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后,发现凹液面低于刻度线又加水补上
探究二:钠与氯气反应
![]() 钠在氯气中燃烧的现象:剧烈燃烧, 火焰呈黄色且有______生成。
钠在氯气中燃烧的现象:剧烈燃烧, 火焰呈黄色且有______生成。
![]() 在实验室用浓盐酸与MnO2共热制取Cl2,并进行相关实验。利用上述方法制取标准状况下
在实验室用浓盐酸与MnO2共热制取Cl2,并进行相关实验。利用上述方法制取标准状况下![]() Cl2,则作还原剂的HCl的物质的量是______。
Cl2,则作还原剂的HCl的物质的量是______。
![]() 粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④用适量盐酸调节溶液的pH等于7 ⑤溶解 ⑥过滤 ⑦蒸发 正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
【答案】2Na+ 2H2O=2Na++ 2OH-+ H2↑ a 6.0 烧杯 CD 白烟 1mol ad
【解析】
⑹把杂质转化为沉淀或气体除去,除钙离子用碳酸根,除镁离子用氢氧根,除硫酸根用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉。
⑴钠和水反应生成氢氧化钠和氢气,化学方程式为![]() ,离子方程式为
,离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
⑵钠的密度比煤油的大,比水的小,所以钠应该在煤油和水的分界线处,故答案为:a;
⑶①配置480mL溶液,没有480mL的容量瓶,只能用500mL的容量瓶,氢氧化钠的质量以500mL来计算,氢氧化钠的物质的量![]() , 氢氧化钠质量
, 氢氧化钠质量![]() ,故答案为:6.0;
,故答案为:6.0;
②在溶解氢氧化钠时还需要烧杯,故答案为:烧杯;
③A.加水定容时,俯视刻度线会导致最终溶液体积偏小,浓度偏大,故A错误;
B.容量瓶的内壁附有水珠而未干燥处理,不会影响最终浓度的大小,故B错误
C. 在溶解过程中有少量液体溅出烧杯外,损失了溶质,最终溶液的体积不变,所以浓度会偏小,故C正确;
D. 颠倒摇匀后,凹液面低于刻度线,是由于配好的溶液附着在瓶塞和瓶壁上,溶液已经配好,再加水相当于稀释溶液,使溶液浓度偏低,故D正确;
故答案为:CD。
⑷钠在氯气中燃烧现象:剧烈燃烧,火焰呈黄色,且有白烟生成,故答案为:白烟;
⑸标准状况下11.2L![]() 的物质的量为
的物质的量为![]()
则:
解得![]() ,被氧化的
,被氧化的![]() 做还原剂生成
做还原剂生成![]() ,做还原剂的
,做还原剂的![]() 的物质的量是参加反应的盐酸量的一半,所以做还原剂的
的物质的量是参加反应的盐酸量的一半,所以做还原剂的![]() 为
为![]() ,故答案为:
,故答案为:![]() ;
;
⑹除去粗盐中的可溶性的杂质:![]() 、
、![]() 、
、![]() 时,先加入过量
时,先加入过量![]() 除去
除去![]()
![]() ,再加入过量
,再加入过量![]() 除去
除去![]()
![]() ,加入过量的
,加入过量的![]() 除去
除去![]() 和多余的
和多余的![]() ,
,![]() 、
、![]() ,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡的顺序可以颠倒,过滤后再加盐酸调节pH等于7,以防沉淀溶解,正确操作顺序为⑤②③①⑥④⑦或⑤③②①⑥④⑦,故答案为:ad;
,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡的顺序可以颠倒,过滤后再加盐酸调节pH等于7,以防沉淀溶解,正确操作顺序为⑤②③①⑥④⑦或⑤③②①⑥④⑦,故答案为:ad;

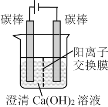
【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3