题目内容
【题目】某可逆反应正向反应过程中能量变化如图,下列说法正确的是
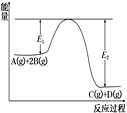
A. 该反应为吸热反应
B. 加入催化剂,反应速率增大,E1减小,E2减小,反应热不变
C. 增大压强,平衡正向移动,K增大
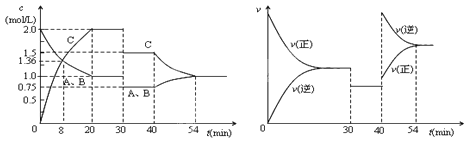
D. 当反应υ正(B)∶υ正(D)=2∶1时,到达平衡状态
【答案】B
【解析】
A.根据图示可知:反应物的总能量高于生成物的总能量,因此该反应为放热反应,A错误;
B.加入催化剂,能够降低反应的活化能,即E1减小,E2减小,因此可以使更多的分子变为活化分子,所以反应速率增大,但E1-E2不变,反应热不变,B正确;
C.根据图示可知反应方程式为:A(g)+2B(g)![]() C(g)+D(g),该反应的正反应是气体体积减小的反应,增大压强,化学平衡向正反应方向移动,但由于温度不变,所以化学平衡常数K不变,C错误;
C(g)+D(g),该反应的正反应是气体体积减小的反应,增大压强,化学平衡向正反应方向移动,但由于温度不变,所以化学平衡常数K不变,C错误;
D.在任何情况下的化学反应速率υ正(B)∶υ正(D)=2∶1,因此不能据此平衡平衡状态,D错误;
故合理选项是B。

【题目】某小组同学探究Cu和H2O2的反应。
(猜想预测)
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
(实验探究)
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10 小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:________。
(继续探究)
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2+ + 4NH3 [ Cu(NH3)4] 2+ ,[ Cu(NH3)4] 2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
装置 | 序号 | 试剂a | 现象 |
| ⅱ | 20 mL 30% H2O与4 mL 5 mol/L H2SO4 混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
ⅲ | 20 mL 30% H2O2与4 mL5 mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是________(用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是________。
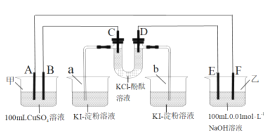
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。
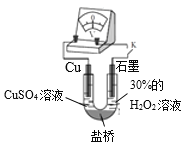
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:_________。利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是_______。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:________。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有________。