题目内容
4.室温下,下列溶液中粒子浓度关系正确的是( )| A. | 0.01mol.L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) | |
| B. | O.lmol.LNaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) | |
| C. | 等物质的量NH4Cl和 NaCl 的混合溶液:c(NH4+)+c(NH3.H20)+c(Na+)=2c(Cl-) | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的Na2CO3溶液:c(HCO3-)+2c(H2CO3)=(10-2-10-12)mol/L |
分析 A.硫化氢为二元弱酸,在溶液中只能部分电离,则c(H2S)>c(H+);
B.根据亚硫酸氢钠溶液中的电荷守恒判断;
C.根据混合液中的物料守恒分析;
D.该溶液中氢氧根离子浓度为10-2mol/L,氢离子浓度为10-12mol/L,结合碳酸钠溶液中的质子守恒进行计算.
解答 解:A.硫化氢溶液中,其电离程度较小,则溶液中c(H2S)最大,溶液中正确的离子浓度大小为:c(H2S)>c(H+)>c(HS-)>c(S2-)>c(OH-),故A错误;
B.O.lmol.LNaHSO3溶液,根据电荷守恒可得:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),所以c(Na+)+c(H+)>c(HSO3-)+c(SO32-)+c(OH-),故B错误;
C.等物质的量NH4Cl和 NaCl 的混合溶液,根据物料守恒可得:c(NH4+)+c(NH3.H20)+c(Na+)=c(Cl-),故C错误;
D.该溶液中氢氧根离子浓度为10-2mol/L,氢离子浓度为10-12mol/L,根据质子守恒c(HCO3-)+2c(H2CO3)+c(H+)=c(OH-)可得:c(HCO3-)+2c(H2CO3)=c(OH-)-c(H+)=(10-2-10-12)mol/L,故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒、质子守恒及盐的水解原理为解答关键,注意掌握判断离子浓度大小的常用方法,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下面说法中正确的是( )
| A. | 标有“ ”的包装材料可以用来包装食品 ”的包装材料可以用来包装食品 | |
| B. | 酒精消毒原理是将病毒彻底氧化 | |
| C. | GaN中的氮和镓均属于第IIIA族元素 | |
| D. | 麦芽糖的水解产物能发生银镜反应 |
12.为实现下列实验目的,下表所提供的实验仪器和试剂都会用到且都正确的是( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 测定中和热 | 量筒、温度计、酒精灯 | 盐酸、NaOH溶液 |
| B | 制备氢氧化铁胶体 | 烧杯、胶头滴管、酒精灯 | 饱和FeCl3溶液 |
| C | 配制10%CuSO4溶液100g | 100ml 容量瓶、玻璃棒 | 胆矾 |
| D | 实验室制取、收集干燥的氨气 | 大试管、酒精灯 | 氯化铵、消石灰、无水CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
19.用如图实验装置进行相应实验,能达到实验目的是( )
| A. | 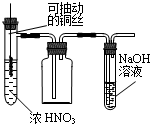 制取少量的NO2 | B. |  电解食盐水制氯气和氢气 | ||
| C. | 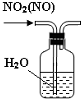 除去NO2中的NO | D. |  用二氧化锰和浓盐酸制氯气 |
9.下列说法正确的是( )
| A. | 若某温度下,0.2 mol/L的醋酸与0.09 mol/L的氢氧化钡等体积混合后呈中性(不考虑混合后溶液体积的变化),则可算出该温度下醋酸的电离常数 K=9×10-7 mol/L | |
| B. | 若某温度下氯化银的Ksp=10-10mol2/L2,则100 mL0.2 mol/L的氯化钠溶液与0.18 mol/L硝酸银溶液等体积混合后(不考虑混合后溶液体积的变化),溶液中c(Ag+)为10-8 mol/L | |
| C. | 若某温度下1 L密闭容器中反应HCHO(g)十H2(g)?CH3OH(g)达到平衡后甲醛的转化率为50%,则该温度下该反应的平衡常数是2(mol/L)-1 | |
| D. | 若向氢氧化钙的饱和溶液中加人氢氧化钠溶液,则会有固体析出 |
16.实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的是( )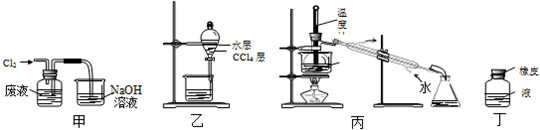

| A. | 用装置甲氧化废液中的溴化氢 | B. | 用装置乙分离CCl4层和水层 | ||
| C. | 用装置丙分离CCl4和液溴 | D. | 用仪器丁长期贮存液溴 |
13.在某恒温密闭容器中,投入一定量的A发生可逆反应 A(s)?B(g)+C(g)△H=-QkJ.mol-1达到平衡.缩小容器体积,重新达到平衡时.以下分析不正确的是( )
| A. | C(g)的浓度与缩小体积前的平衡浓度相等 | |
| B. | 平衡时,单位时间内n(A)消耗:n(C)消耗=1:1 | |
| C. | 若保持体积不变,向平衡体系中加入少量的A,平衡不移动 | |
| D. | 若开始时向容器中加入1 mol B和1 molC,达到平衡时吸收热量Q kJ |
14.在如图所示的原电池中,下列说法正确的是( )


| A. | 负极发生还原反应 | B. | 正极反应为 Cu-2e-═Cu2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 反应一段时间后,溶液的酸性减弱 |