题目内容
5.两个研究性学习小组分别利用盐湖苦卤和铝土矿提取并制备有用的化学物质.甲组:从盐湖苦卤中制取较纯净的氯化钾及液溴,设计了如下流程:(盐湖苦卤的浓缩液富含K+、Mg2+、Br-、SO42-、Cl-等),回答一下问题:

(1)图中氧化剂可以选择B.
A.I2 B.Cl2 C.S
(2)操作Ⅰ的名称:萃取、分液;
(3)依次加入的试剂为x,y,z的化学式为BaCl2、KOH、K2CO3;
(4)无色溶液B中可能含有的离子有氢氧根离子、氯离子、钾离子和碳酸根离子,检验其中是否含有Cl-的方法是取试样少许加入HNO3酸化后,应该再加入含有Ag+的溶液,观察是否有白色沉淀生成.
分析 流程操作为在盐湖苦卤的浓缩液中加入氧化剂应为氯气,可生成溴,通过萃取、分液的方法分离,浓缩后得到硫酸镁和氯化钾的混合液,经重结晶可得硫酸镁,过滤得到氯化钾溶液,经降温结晶,过滤可得到氯化钾;
(1)图中氧化剂可以选择是氯气;
(2)操作Ⅰ为互不相溶的液体的分离,应为萃取分液;
(3)除去溶液中的Mg2+、SO42-,应分别加入过量的BaCl2、KOH、K2CO3;
(4)因为依次加入过量的BaCl2、KOH、K2CO3,所以无色溶液B中可能含有的离子有氢氧根离子、氯离子、钾离子和碳酸根离子,检验其中是否含有Cl-是先除去溶液中的碳酸根离子,检验Cl-的方法是利用Ag++Cl-=AgCl↓产生白色沉淀的原理,加入HNO3酸化后,应该再加入含有Ag+的溶液.
解答 解:(1)氧化剂应为氯气,通入氯气发生:Cl2+2Br-=2Cl-+Br2,所以选择氯气,故选:B;
(2)氧化剂应为氯气,通入氯气发生:Cl2+2Br-=2Cl-+Br2,加入CCl4,溴易溶于CCl4,溶液分层,用萃取、分液的方法分离,故答案为:萃取、分液;
(3)除去溶液中的Mg2+、SO42-,类似于粗盐的提纯,加入过量BaCl2可除去SO42-,加入过量KOH溶液可除去Mg2+,最后加入K2CO3可除去BaCl2,所以试剂为x,y,z分别加入过量的BaCl2、KOH、K2CO3,故答案为:BaCl2、KOH、K2CO3;
(4)因为依次加入过量的BaCl2、KOH、K2CO3,所以无色溶液B中可能含有的离子有氢氧根离子、氯离子、钾离子和碳酸根离子,取试样少许加入HNO3酸化后,应该再加入含有Ag+的溶液,观察是否有白色沉淀生成,如果有白色沉淀说明存在氯离子,
故答案为:氢氧根离子、氯离子、钾离子和碳酸根离子;取试样少许加入HNO3酸化后,应该再加入含有Ag+的溶液,观察是否有白色沉淀生成.
点评 本题综合考查物质的制备、分离和提纯的实验设计和评价,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意把握物质的分离、提纯原理,根据实验流程解答该题,答题时要注意审题,把握实验的目的和原理.

| A. | 在涂料中尽量用液态有机物代替水作溶剂,以减少环境污染 | |
| B. | 向煤中加入适量石灰石,在煤燃烧时SO2最终生成CaSO4,可减少对大气的污染 | |
| C. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| D. | 食物溶于水后的溶液 pH<7,则该食物为成酸性食物 |
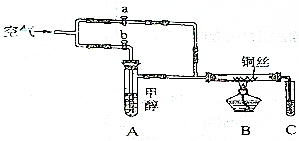 如图所示装置,通入空气,开启a、b两个活塞,灼热铜丝,下列有关分析正确的是( )
如图所示装置,通入空气,开启a、b两个活塞,灼热铜丝,下列有关分析正确的是( )| A. | 灼热铜丝发生的现象变化为紫红色和黑色交替出现,甲醇发生还原反应 | |
| B. | C中有机产物易溶于水,与水分子间只形成1种氢键 | |
| C. | 检验C中产物的试剂可用1mol•L-1的CuSO4溶液2mL和0.4mol•L-1的NaOH | |
| D. | 可用酸性高锰酸钾溶液检验产物生成 |
| A. | C3H6O2 | B. | C5H8O2 | C. | C8H18O2 | D. | C6H10O2 |
①CH3CH2CH2CH2CH2CH3②
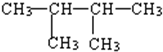 ③
③ ④
④
| A. | ①>②>③>④ | B. | ③=①>②>④ | C. | ③>②>④>① | D. | ②>③=①>④ |
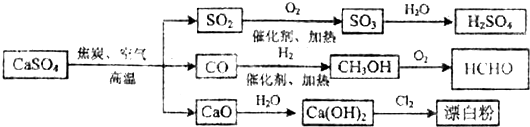
| A. | 除去与水反应外,图示中其它的转化反应均为氧化还原反应 | |
| B. | CO、SO2、SO3 均是酸性氧化物 | |
| C. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| D. | 用CO合成CH3OH 进而合成HCHO的两步反应,原子利用率均为100% |
| A. | 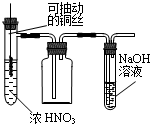 制取少量的NO2 | B. |  电解食盐水制氯气和氢气 | ||
| C. | 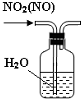 除去NO2中的NO | D. |  用二氧化锰和浓盐酸制氯气 |
| A. | KOH | B. | H2O | C. | CaCl2 | D. | NH3 |