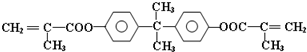
题目内容
15.下列叙述错误的是( )| A. | 工业上,乙苯主要通过苯与乙烯在合适条件下加成反应获得 | |
| B. | 实验室制得的溴苯含有多种有机杂质,除了苯之外,还可能含 | |
| C. | 萘(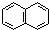 )不是苯的同系物,应属于联苯类芳香烃 )不是苯的同系物,应属于联苯类芳香烃 | |
| D. | D.甲苯与氯气在光照下反应生成的一氯代物主要为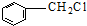 |
分析 A.苯和乙烯发生加成反应生成乙苯;
B.苯可溴发生取代反应,可生成溴苯、二溴苯等;
C.萘和苯的结构不同;
D.甲苯含有甲基,甲基可在光照条件下发生取代反应.
解答 解:A.苯和乙烯在一定条件下可发生加成反应生成乙苯,故A正确;
B.苯可溴发生取代反应生成溴苯,溴苯继续与溴发生取代反应,可取代溴原子邻位、对位氢原子,生成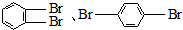 ,故B正确;
,故B正确;
C.萘和苯的结构不同,不是同系物,萘属于稠环化合物,不是联苯类芳香烃,故C错误;
D.甲苯含有甲基,甲基可在光照条件下发生取代反应,如在催化作用下,可取代苯环上的氢原子,故D正确.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构特点以及性质,为解答该类题目的关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
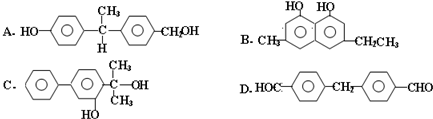
5.请根据官能团的不同对下列有机物进行分类
①CH3CH2OH ②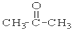 ③CH3CH2Br ④
③CH3CH2Br ④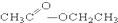 ⑤
⑤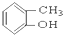 ⑥
⑥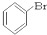 ⑦
⑦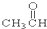 ⑧
⑧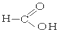 ⑨
⑨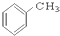 ⑩
⑩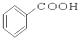
(1)芳香烃:⑨;(2)醇:①;
(3)醛:⑦;(4)酮:②;
(5)酚:⑤;(6)酯:④.
①CH3CH2OH ②
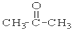 ③CH3CH2Br ④
③CH3CH2Br ④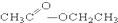 ⑤
⑤ ⑥
⑥ ⑦
⑦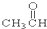 ⑧
⑧ ⑨
⑨ ⑩
⑩
(1)芳香烃:⑨;(2)醇:①;
(3)醛:⑦;(4)酮:②;
(5)酚:⑤;(6)酯:④.
6.随着人们生活质量的不断提高,废电器必须进行集中处理的问题被提到议事日程,其首要原因是( )
| A. | 利用电器中的金属材料 | B. | 防止电器造成污染 | ||
| C. | 废电器经过处理后还可以重新使用 | D. | 回收其中非金属材料 |
10.已知某“瘦肉精”中含有克伦特罗,其结构如图,下列有关克伦特罗的叙述不正确的是( )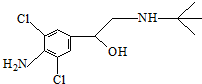

| A. | 该物质在一定条件下可发生消去反应和酯化反应 | |
| B. | 该物质分子中含有6个饱和碳原子 | |
| C. | 1 mol该物质与足量NaOH溶液反应,最多需NaOH 2 mol | |
| D. | 该物质的分子式为C12H18ON2Cl2 |
20.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应中,反应物吸收环境中的热量转化为产物内部的能量 |
7.为回收利用废钒催化剂(含有V2O5,、及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如图1:
已知部分含钒物质在水中的溶解性如下:
回答下列问靥:
(1)工业由V2O5冶炼金厲钒常用铝热法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(2)滤液中含钒的主要成分为VOSO4 (写化学式).
(3)反应③的沉淀率是回收钒的关键,该步反应的离子方程式为NH4++VO3-=NH4VO3↓;沉淀率的髙
低除受溶液pH影响外,还与氯化按系数(NH4Cl加入质量与样品中V2O5的质量比)和温度有关.根据图2判断最佳氯化铵系数和温度分别为4、80°C.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,该滴定反应的离子方程式2VO2++H2C2O4+2H+═2VOn++2CO2↑+2H2O.若产生2.24L的CO2(标准状况下),则转移电子数为0.1NA.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO${\;}_{2}^{+}$+V2++H+ $?_{放电}^{充电}$ VO2++H2O+V3+
电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
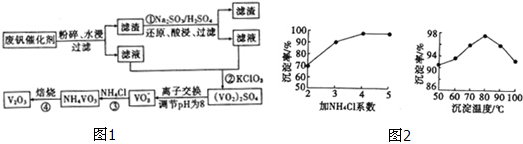
已知部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金厲钒常用铝热法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(2)滤液中含钒的主要成分为VOSO4 (写化学式).
(3)反应③的沉淀率是回收钒的关键,该步反应的离子方程式为NH4++VO3-=NH4VO3↓;沉淀率的髙
低除受溶液pH影响外,还与氯化按系数(NH4Cl加入质量与样品中V2O5的质量比)和温度有关.根据图2判断最佳氯化铵系数和温度分别为4、80°C.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,该滴定反应的离子方程式2VO2++H2C2O4+2H+═2VOn++2CO2↑+2H2O.若产生2.24L的CO2(标准状况下),则转移电子数为0.1NA.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO${\;}_{2}^{+}$+V2++H+ $?_{放电}^{充电}$ VO2++H2O+V3+
电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.

4.下列叙述从化学角度分析,其中正确的是( )
| A. | 相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃中的碳的质量分数越大 | |
| B. | 相同质量的烃,完全燃烧,消耗的O2越多,说明烃中的氢的质量分数越大 | |
| C. | 银镜反应实验后试管内壁附有银,可用氨水清洗 | |
| D. | 氟利昂(CF2Cl2)或氮氧化物(NOx)气体会破坏大气臭氧层,从而导致“温室效应” |
5.盛放下列试剂的试剂瓶不能用玻璃塞的是( )
| A. | 氢氧化钠溶液 | B. | 盐酸 | C. | 硫酸钠溶液 | D. | AgNO3溶液 |