题目内容
7. 环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.
环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.(1)工业上可以利用CO为原料制取CH3OH.
已知:CO2(g)+3H2(g)?CH2OH(g)+H2O(g)△H=-49.5kJ•mol-1
CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ•mol-1
(1)写出由CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol;
(2)(1)中反应能自发进行的条件是低温;
(3)某温度下,(1)中反应的平衡常数K=0.25,改变下述条件可使K=2.04的有D.
A.增大压强 B.增大CO的密度 C.升高温度 D.降低温度 E.使用催化剂
(II)工业是也可以利用CO2为原料制取CH3CH2OH.下面为CO2和H2制取乙醇的反应:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O (g)△H=QkJ/mol(Q>0)z
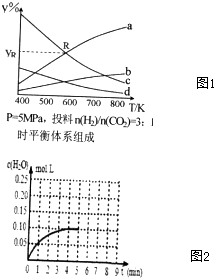
在密闭容器中,按CO2与H2的物质质量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各物质的体积分数(y%)如图1所示.
(1)图1中表示CH3CH2OH体积分数曲线的是b;
(2)在一定温度下反应达到平衡的标志是BC.
A.平衡常数K不再增大;
B.CO2的转化率不再增大;
C.混合气体的平均相对分子质量不再改变;
D.反应物不再转化为生成物.
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是B,达到平衡后,能提高H2的转化率的操作是C.
A.降低温度B.充入更多的H2 C.移去乙醇 D增大容器体积
(4)图1中曲线a和c的交点R对应物质的体积分数ya=37.5%.
(III)一定条件下CO可转化为CO2,温度T1时,CO(g)+H2O(g)?CO2(g)+H2(g),在体积为2L的密闭容积中加入0.4molCO2和0.4molH2,第4分钟达到平衡,反应中c(H2O)的变化情况如图2所示.在第5分钟时,向体系中再充入0.2molCO和0.2molH2O(其他条件不变).第8分钟达到平衡,请在图2中画出5到9分钟的c(H2O)浓度变化趋势的曲线.
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)反应自发进行的判断依据是△H-T△S<0;
(3)平衡常数随温度变化,某温度下,(1)中反应的平衡常数K=0.25,改变下述条件可使K=2.04,说明改变温度平衡正向进行;
(Ⅱ)(1)该反应为吸热反应,升高温度平衡正向移动,平衡时CO2与H2的含量降低,CH3CH2OH与H2O的含量增大.开始CO2 与H2 的物质的量之比1:3进行,平衡时H2的含量是CO2的含量三倍;CH3CH2OH与H2O按1:3生成,平衡时H2O的含量是CH3CH2OH含量的三倍;
(2)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(3)根据外界条件对反应速率的影响分析判断,降低温度、减小浓度、减小压强等都减小反应速率;
(4)R点为a和c的交点,设此时a的H2O体积为V,那么c的H2体积也为V,根据方程式中的关系求出CO2和CH3CH2OH的体积,再求体积分数ya;
(Ⅲ)在体积为2L的密闭容积中加入0.4molCO2和0.4molH2,第4分钟达到平衡,水的浓度为0.1mol/L,在第5分钟时,向体系中再充入0.2molCO和0.2molH2O(其他条件不变),水的浓度增大一倍,曲线起始时水的浓度为0.2mol/L,随反应进行第8分钟达到平衡,此时水的浓度结合化学平衡常数计算得到,据此画出曲线的变化;
解答 解:(1)①CO2(g)+3H2(g)?CH2OH(g)+H2O(g)△H=-49.5kJ•mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ•mol-1
盖斯定律计算①-②得到由CO和H2制取甲醇的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol,
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol;
(2)CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol,反应的焓变△H<0,△S<0,满足△H-T△S<0的自发进行的反应条件为低温;
故答案为:低温;
(3)平衡常数随温度变化,某温度下,(1)中反应的平衡常数K=0.25,改变下述条件可使K=2.04,说明改变温度平衡正向进行,钙反应是放热反应,实验降低温度平衡正向进行,故选D;
故答案为:D.
(Ⅱ):(1)该反应为吸热反应,升高温度平衡正向移动,平衡时CO2与H2的含量降低,CH3CH2OH与H2O的含量增大.开始CO2 与H2 的物质的量之比1:3进行,平衡时H2的含量是CO2的含量三倍;CH3CH2OH与H2O按1:3生成,平衡时H2O的含量是CH3CH2OH含量的三倍;
曲线a、曲线b随温度升高含量增大,且曲线a的含量高,所以曲线a表示H2O、曲线b表示CH3CH2OH;
曲线c、曲线d随温度升高含量减小,且曲线c的含量高,所以曲线c表示H2、曲线d表示CO2.
故答案为:b;
(2)A.平衡常数K只与温度有关,与是否达到平衡状态无关,故A错误;
B.CO2的转化率不再增大,说明达到平衡状态,故B正确;
C.平均分子量=$\frac{总质量}{总物质的量}$,总质量不变,总物质的量会变,故混合气体的平均相对分子质量不再改变可作为判断是否达到化学平衡状态的依据,故C正确;
D.该反应是可逆反应,不存在反应物不再转化为生成物的状态,故D错误;
故答案为:BC;
(3)A.降低温度,二氧化碳反应速率减小,平衡逆向移动,氢气的转化率降低;
B.充入更多的H2,二氧化碳反应速率增大,平衡正向移动,氢气的转化率降低;
C.移去乙醇,二氧化碳反应速率减小,平衡正向移动,氢气的转化率增大;
D.增大容器体积,压强减小,二氧化碳反应速率减小,平衡逆向移动,氢气的转化率降低;
故提高CO2的反应速率,可以采取的反应条件是B;能提高H2转化率的操作是C;
故答案为:B;C;
(4)2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g);
R点为a和c的交点,设此时a的H2O体积为6V,那么c的H2体积也为6V,根据方程式可知CO2为$\frac{6V}{6}$=2V,C2H5OH为$\frac{6V}{3}$=2V,
所以R点对应的体积分数ya=$\frac{6V}{6V+6V+2V+2V}$×100%=37.5%,
故答案为:37.5;
(Ⅲ)在体积为2L的密闭容积中加入0.4molCO2和0.4molH2,第4分钟达到平衡,水的浓度为0.1mol/L,在第5分钟时,向体系中再充入0.2molCO和0.2molH2O(其他条件不变),水的浓度增大一倍,曲线起始时水的浓度为0.2mol/L,随反应进行第8分钟达到平衡,此时水的浓度,结合平衡常数计算得到;
CO(g)+H2O(g)?CO2(g)+H2(g),
起始量(mol/L) 0 0 0.2 0.2
变化量(mol/L) 0.1 0.1 0.1 0.1
平衡量(mol/L) 0.1 0.1 0.1 0.1
平衡常数K=1
在第5分钟时,向体系中再充入0.2molCO和0.2molH2O(其他条件不变),水的浓度增大一倍,起始量为0.2mol/L.结合化学平衡三段式列式计算,设得到平衡消耗水物质的量浓度为x
CO(g)+H2O(g)?CO2(g)+H2(g),
起始量(mol/L) 0.2 0.2 0.1 0.1
变化量(mol/L) x x x x
平衡量(mol/L) 0.2-x 0.2-x 0.1+x 0.1+x
K=$\frac{(0.1+x)^{2}}{(0.2-x)^{2}}$=1
x=0.05mol/L
平衡后水的平衡浓度为0.2mol/l-0.05mol/L=0.15mol/L,据此画出图象为: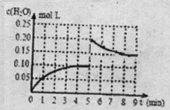 ,
,
故答案为: ;
;
点评 本题考查热化学方程式书写,化学平衡影响因素分析,反应速率、反应平衡常数的计算,对图象的分析与平衡移动及平衡状态的特征的理解,难度较大,注意图象起点、终点和过程中变化趋势是画图象的关键.

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案| A. | 1种 | B. | 3种 | C. | 6种 | D. | 8种 |
| A. | 用向下排空气法收集CO2 | B. | 用碱石灰干燥SO2 | ||
| C. | 通入Cl2出去FeCl3中FeCl2 | D. | 用HCl除去Na2CO3中的NaHCO3 |
| A. | 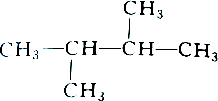 和 和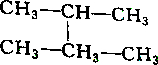 | B. | 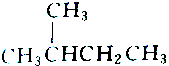 和 和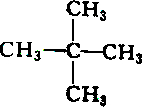 | ||
| C. | 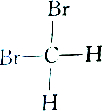 和 和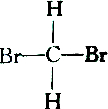 | D. | 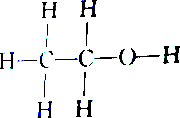 和 和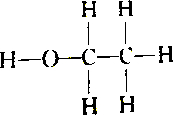 |
| A. | Na[Al(OH)4]溶液中通入过量CO2:2[Al(OH)4]-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氧化铜溶于稀盐酸中:CuO+2H+=Cu2++2H2O | |
| D. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| A. | CO和N2 | B. | CO2和N2O | C. | CO32-和NO3- | D. | CO2和SO2 |
| A. | 密度比空气大 | B. | 能溶于水 | ||
| C. | 有一定颜色 | D. | 沸点比其他气体低 |
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ•mol-1
向1L0.5mol/L的NaOH溶液中分别加入①稀醋酸、②浓硫酸、③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3、它们的关系正确的是( )
| A. | △H1>△H2>△H3 | B. | △H2<△H3<△H1 | C. | △H1=△H2=△H3 | D. | △H1<△H3<△H2 |