题目内容
8.下列实验方案可行的是( )| A. | 用向下排空气法收集CO2 | B. | 用碱石灰干燥SO2 | ||
| C. | 通入Cl2出去FeCl3中FeCl2 | D. | 用HCl除去Na2CO3中的NaHCO3 |
分析 A.常温下和空气中氧气不反应、密度大于空气的应该采用向上排空气法收集;
B.酸性氧化物应该用酸性或中性干燥剂干燥;
C.氯气和氯化亚铁反应生成氯化铁;
D.盐酸和碳酸钠、碳酸氢钠都反应.
解答 解:A.常温下和空气中氧气不反应、密度大于空气的应该采用向上排空气法收集,二氧化碳密度大于空气,应该采用向上排空气法收集,故A错误;
B.酸性氧化物应该用酸性或中性干燥剂干燥,二氧化硫和碱石灰反应,所以不能用碱石灰干燥,可以用浓硫酸干燥,故B错误;
C.氯气和氯化亚铁反应生成氯化铁且不产生杂质,故C正确;
D.盐酸和碳酸钠、碳酸氢钠都反应,所以不能用稀盐酸除去碳酸钠中的碳酸氢钠,固体时应该采用加热方法除去碳酸氢钠,故D错误;
故选C.
点评 本题考查化学实验方案评价,涉及除杂、气体的收集和干燥,明确实验原理是解本题关键,会从物质的性质及实验操作方法能方面进行评价,易错选项是D.

练习册系列答案
相关题目
18.一氧化碳、烯烃和氢气在催化剂作用下发生烯烃的醛化反应,如由乙烯可制丙醛:
CH2═CH2+CO+H2催化剂→CH3CH2CHO
由丙烯进行醛化反应也可得到醛,下列说法正确的是( )
CH2═CH2+CO+H2催化剂→CH3CH2CHO
由丙烯进行醛化反应也可得到醛,下列说法正确的是( )
| A. | 能得到一种醛 | B. | 能得到二种醛 | ||
| C. | 能得到三种醛 | D. | 该反应为取代反应 |
19.下列各组物质中,化学键类型完全相同的一组是( )
| A. | Na2O2和H2O2 | B. | KOH和H2SO4 | C. | CCl4和KCl | D. | MgCl2和Na2O |
16.下列化合物中同分异构体数目(其中芳香族化合物的同分异构体要仍未芳香族化合物)最多的是( )
| A. | 丁烯 | B. | 乙苯 | C. | 苯甲醇 | D. | 丙酸甲酯 |
13.实验室在2L的密闭容器里加入0.1molCO和0.1molNO,在T℃进行反应,有关数据记录如表:
(1)0~10s内用N2表示该反应的平均反应速率为0.0015mol/(L•s);
(2)T℃下该反应的平衡常数(N2化学计量数为1)为3200.
| 时间/s | 5 | 10 | 15 | 20 | 25 |
| n(CO2)/mol | 0.04 | 0.06 | 0.07 | 0.08 | 0.08 |
(2)T℃下该反应的平衡常数(N2化学计量数为1)为3200.
4.下列说法中不正确的是( )
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 吸热反应需要加热后才能发生 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出还是吸收能量 |
5.下列叙述正确的是( )
| A. | 金属元素与非金属元素间只能形成离子键 | |
| B. | 非金属元素不可能形成离子化合物? | |
| C. | 离子化合物中可能有共价键? | |
| D. | 共价化合物中可能有离子键? |

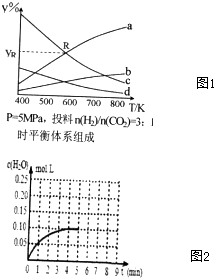 环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.
环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.