题目内容
11.实验室常用大理石与稀盐酸反应制取CO2.不用纯碱与盐酸或硫酸反应制取CO2的考虑是:①纯碱比大理石(或石灰石)成本高,不经济;
②反应速率太快,难于控制和收集.但反应速率可以通过改变反应条件来控制.
作为研究,请你提出用纯碱与盐酸反应制取CO2的适宜途径,并用实验来检验你的设计.
分析 从“反应速率太快,难于控制和收集.但反应速率可以通过改变反应条件来控制”得出:只要让反应慢下来即可解决.
解答 解:由于纯碱与盐酸充分接触,化学反应速率即较快,故可以采取将纯碱溶解生成溶液,然后滴加盐酸的方法,依据原理是:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2+↑+H2O,所需仪器是:烧杯、玻璃棒、锥形瓶(或圆底烧瓶)、双孔塞、分液漏斗,实验步骤是:溶解纯碱,在锥形瓶中注入适量的纯碱溶液,上塞双孔塞,一孔插入分液漏斗,一孔插入导气管,实验室时,可通过分液漏斗调节注入稀盐酸的量,从而达到控制反应的目的,
答:溶解纯碱,在锥形瓶中注入适量的纯碱溶液,上塞双孔塞,一孔插入分液漏斗,一孔插入导气管,实验室时,可通过分液漏斗调节注入稀盐酸的量,观察气体生成,从而达到控制反应的目的.
点评 本题主要考查的是实验室中常见气体的制备以及实验方案的设计,有一定难度,把纯碱变为溶液使用,熟练灵活利用酸与盐的反应原理是解决本题的关键.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
1.能证明SO2中混有CO2的方法是( )
| A. | 通过品红溶液 | |
| B. | 通过澄清石灰水 | |
| C. | 先通过高锰酸钾溶液,再通过澄清石灰水 | |
| D. | 先通过澄清石灰水,再通过高锰酸钾溶液 |
19.下列各组物质中,化学键类型完全相同的一组是( )
| A. | Na2O2和H2O2 | B. | KOH和H2SO4 | C. | CCl4和KCl | D. | MgCl2和Na2O |
16.下列化合物中同分异构体数目(其中芳香族化合物的同分异构体要仍未芳香族化合物)最多的是( )
| A. | 丁烯 | B. | 乙苯 | C. | 苯甲醇 | D. | 丙酸甲酯 |
8.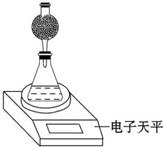 某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
(1)他们能完成哪些因素对速率影响的探究?
探究同体积下HNO3浓度对该反应剧烈程度的影响、探究接触面积对该反应剧烈程度的影响、探究温度对该反应剧烈程度的影响.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
(3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.
(4)该实验小组用如图实验装置进行实验.
①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有量筒、秒表.
②干燥管中应放置的试剂是BC.
A.碱石灰 B.无水CaCl2C.P2O5固体 D.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
 某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.(1)他们能完成哪些因素对速率影响的探究?
探究同体积下HNO3浓度对该反应剧烈程度的影响、探究接触面积对该反应剧烈程度的影响、探究温度对该反应剧烈程度的影响.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
(4)该实验小组用如图实验装置进行实验.
①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有量筒、秒表.
②干燥管中应放置的试剂是BC.
A.碱石灰 B.无水CaCl2C.P2O5固体 D.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
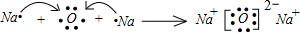
 或
或

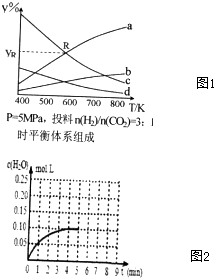 环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.
环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.