题目内容
12.下列反应的离子方程式正确的是( )| A. | Na[Al(OH)4]溶液中通入过量CO2:2[Al(OH)4]-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氧化铜溶于稀盐酸中:CuO+2H+=Cu2++2H2O | |
| D. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
分析 A.二氧化碳过量反应生成碳酸氢钠;
B.碳酸镁为沉淀,应保留化学式;
C.氧化铜与盐酸反应生成氯化铜和水;
D.反应生成硫酸钡、硫酸钠和和水.
解答 解:A.Na[Al(OH)4]溶液中通入过量CO2,离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故A错误;
B.往碳酸镁中滴加稀盐酸,离子方程式:MgCO3+2H+═CO2↑+H2O+Mg2+,故B错误;
C.氧化铜溶于稀盐酸中,离子方程式:CuO+2H+=Cu2++2H2O,故C正确;
D.向Ba(OH)2溶液中滴加NaHSO4溶液至中性,反应离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
相关题目
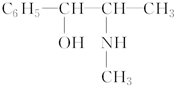
16.下列化合物中同分异构体数目(其中芳香族化合物的同分异构体要仍未芳香族化合物)最多的是( )
| A. | 丁烯 | B. | 乙苯 | C. | 苯甲醇 | D. | 丙酸甲酯 |
13.实验室在2L的密闭容器里加入0.1molCO和0.1molNO,在T℃进行反应,有关数据记录如表:
(1)0~10s内用N2表示该反应的平均反应速率为0.0015mol/(L•s);
(2)T℃下该反应的平衡常数(N2化学计量数为1)为3200.
| 时间/s | 5 | 10 | 15 | 20 | 25 |
| n(CO2)/mol | 0.04 | 0.06 | 0.07 | 0.08 | 0.08 |
(2)T℃下该反应的平衡常数(N2化学计量数为1)为3200.
17.下列现象与氢键的作用有关的是( )
①NH3、HF、H2O的熔、沸点比同族其他元素氢化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素[CO(NH2)2]的熔、沸点比醋酸的高
⑤DNA的结构和生物活性
⑥水分子高温下也很稳定
⑦SiO2的硬度大,熔沸点高
⑧干冰用于人工降雨
⑨SO3与水的反应是放热反应.
①NH3、HF、H2O的熔、沸点比同族其他元素氢化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素[CO(NH2)2]的熔、沸点比醋酸的高
⑤DNA的结构和生物活性
⑥水分子高温下也很稳定
⑦SiO2的硬度大,熔沸点高
⑧干冰用于人工降雨
⑨SO3与水的反应是放热反应.
| A. | ①②③④⑤ | B. | ②③④⑤⑥⑦ | C. | ①②④⑤⑨ | D. | ①②③⑤⑧ |
4.下列说法中不正确的是( )
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 吸热反应需要加热后才能发生 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出还是吸收能量 |
1.下列关于催化剂的说法,正确的是( )
| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 催化剂在化学反应前后,化学性质和质量都不变 | |
| C. | 催化剂不参加化学反应 | |
| D. | 任何化学反应,都需要催化剂 |
 ;
;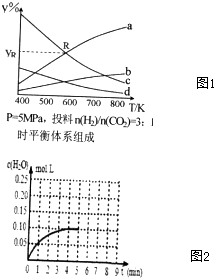 环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.
环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.