��Ŀ����
17��ǿ���ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦ��H+��aq��+OH-��aq��=H2O��l������H=-57.3kJ•mol-1
��1L0.5mol/L��NaOH��Һ�зֱ�����ϡ���ᡢ��Ũ���ᡢ��ϡ���ᣬǡ����ȫ��Ӧ����ЧӦ�ֱ�Ϊ��H1����H2����H3�����ǵĹ�ϵ��ȷ���ǣ�������
| A�� | ��H1����H2����H3 | B�� | ��H2����H3����H1 | C�� | ��H1=��H2=��H3 | D�� | ��H1����H3����H2 |
���� ϡ��ǿ����ǿ������1molH2O�ų�������Ϊ�к��ȣ�ע��������ʵĵ������ȣ�Ũ��������ˮ���������
��� �⣺ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦ��H+��aq��ʮOH-��aq��=H2O����H=һ57.3kJ/mol���ֱ���1L 0.5mol/L��NaOH��Һ�м��룺��ϡ�����ŨH2SO4����ϡ���ᣬ����ĵ������ȣ�Ũ��������ˮ���ȣ���ǡ����ȫ��Ӧʱ�ķų�������Ϊ�ڣ��ۣ��٣����ԡ�H2����H3����H1��
��ѡB��
���� ���⿼���к��ȣ���ȷ�к��ȵĸ��������ʵĵ��롢Ũ��������ˮ����ЧӦ���ɽ���ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
8�� ij̽��С���ò���HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����أ���ѡ�Լ���1.00mol•L-1 HNO3��2.00mol•L-1 HNO3��ϸ��������ʯ���ֿ�������ʯ��35��ˮԡ��
ij̽��С���ò���HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����أ���ѡ�Լ���1.00mol•L-1 HNO3��2.00mol•L-1 HNO3��ϸ��������ʯ���ֿ�������ʯ��35��ˮԡ��
��1�������������Щ���ض�����Ӱ���̽����
̽��ͬ�����HNO3Ũ�ȶԸ÷�Ӧ���ҳ̶ȵ�Ӱ�졢̽���Ӵ�����Ը÷�Ӧ���ҳ̶ȵ�Ӱ�졢̽���¶ȶԸ÷�Ӧ���ҳ̶ȵ�Ӱ�죮
��2��������ܽ��е�̽�����ݣ���д����ʵ����Ʊ������̽��ʵ�飺
��3������ʵ����Ӧ���ƵIJ�������������Һ�����CaCO3������
��4����ʵ��С������ͼʵ��װ�ý���ʵ�飮
�ٳ�������ƽ������ܡ���ƿ��ҩ�ס������������⣬�����ʵ������������Ͳ�������
�ڸ������Ӧ���õ��Լ���BC��
A����ʯ�� B����ˮCaCl2C��P2O5���� D��Ũ����
�������������װ�ã���������ƫ���ƫ����ƫС�����䡱����
 ij̽��С���ò���HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����أ���ѡ�Լ���1.00mol•L-1 HNO3��2.00mol•L-1 HNO3��ϸ��������ʯ���ֿ�������ʯ��35��ˮԡ��
ij̽��С���ò���HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����أ���ѡ�Լ���1.00mol•L-1 HNO3��2.00mol•L-1 HNO3��ϸ��������ʯ���ֿ�������ʯ��35��ˮԡ����1�������������Щ���ض�����Ӱ���̽����
̽��ͬ�����HNO3Ũ�ȶԸ÷�Ӧ���ҳ̶ȵ�Ӱ�졢̽���Ӵ�����Ը÷�Ӧ���ҳ̶ȵ�Ӱ�졢̽���¶ȶԸ÷�Ӧ���ҳ̶ȵ�Ӱ�죮
��2��������ܽ��е�̽�����ݣ���д����ʵ����Ʊ������̽��ʵ�飺
| ʵ���� | T/�� | ����ʯ��� | HNO3Ũ��/mol•L-1 |
| �� | ���� | 2.00 | |
| �� | 1.00 | ||
| �� | 2.00 | ||
| �� | 2.00 |
��4����ʵ��С������ͼʵ��װ�ý���ʵ�飮
�ٳ�������ƽ������ܡ���ƿ��ҩ�ס������������⣬�����ʵ������������Ͳ�������
�ڸ������Ӧ���õ��Լ���BC��
A����ʯ�� B����ˮCaCl2C��P2O5���� D��Ũ����
�������������װ�ã���������ƫ���ƫ����ƫС�����䡱����
5������������ȷ���ǣ�������
| A�� | ����Ԫ����ǽ���Ԫ�ؼ�ֻ���γ����Ӽ� | |
| B�� | �ǽ���Ԫ�ز������γ����ӻ�����? | |
| C�� | ���ӻ������п����й��ۼ�? | |
| D�� | ���ۻ������п��������Ӽ�? |
12������˵����ȷ���ǣ�������
| A�� | ��ˮ���ܵ�������ӵĻ�����һ�������ӻ����� | |
| B�� | CO2�����к����Լ���������ˮ�ܵ��磬����CO2�ǵ���� | |
| C�� | Ca��OH��2����ˮ��������������� | |
| D�� | CH3COOH��ˮ��ֻ�ܲ��ֵ��룬������������� |
9���Ҵ������еĸ��ֻ�ѧ����ͼ��ʾ�����й����Ҵ��ڸ��ַ�Ӧ�ж��Ѽ���˵������ȷ���ǣ�������
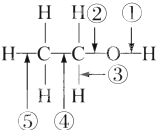

| A�� | �ͽ����Ʒ�Ӧʱ�ټ����� | |
| B�� | ��ͭ����������������O2��Ӧʱ���Ѣټ��͢ۼ� | |
| C�� | ��ͭ����������������O2��Ӧʱ���Ѣټ��͢ݼ� | |
| D�� | �ڿ�������ȫȼ��ʱ���Ѣ٢ڢۢܢݼ� |
6�������ѱ���Ϊ21���͵�����ȼ�ϣ�Ҳ�������������������ȣ��Գ��������ƻ����ã���ҵ�ϳ����ü״�������ˮ������ȡ���䷴Ӧ����ʽΪ��
2CH3OH��g���TCH3OCH3��g��+H2O��g��
���������գ�
��1���л�������ж���̼Ԫ�أ�д��̼ԭ���������ӵĹ����ʾʽ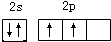 ��
��
д���״������й����ŵĵ���ʽ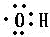 ��
��
��2��̼��ͬ����Ķ�����Ԫ����ȣ��ǽ����Խ�ǿ����C����Ԫ�ط��ţ���д��һ����֤����Ľ��۵Ļ�ѧ����ʽNa2SiO3+CO2+H2O=Na2CO3+H2SiO3����
��3�����¶Ⱥ�������������£���˵����Ӧ�Ѵﵽƽ��״̬����ac��ѡ���ţ�
a��CH3OH������������CH3OCH3����������֮��Ϊ2��1
b��������ѹǿ���ֲ���
c��H2O��g��Ũ�ȱ��ֲ���
d������ƽ����Է����������ֲ���
��4��һ���¶��£����������ԼΪ2.0L�ĺ����ܱ������з���������Ӧ��
����Ҫ���CH3OH��ƽ��ת���ʣ����Բ�ȡ�Ĵ�ʩ��ad��ѡ���ţ���
a����ʱ���߲��� b�������¶� c������CH3OHd�������¶�
��I�������ڵķ�Ӧ����t min�ﵽƽ�⣬��CH3OH��ƽ����Ӧ����Ϊ$\frac{0.16}{t}$mol/��L��min�����ú�t��ʽ�ӱ�ʾ����II��������a=0.32mol��
��5������ʼʱ������I�г���CH3OH 0.2mol��CH3OCH30.30mol��H2O 0.20mol����Ӧ����������������桱����Ӧ������У�
2CH3OH��g���TCH3OCH3��g��+H2O��g��
���������գ�
��1���л�������ж���̼Ԫ�أ�д��̼ԭ���������ӵĹ����ʾʽ
 ��
��д���״������й����ŵĵ���ʽ
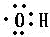 ��
����2��̼��ͬ����Ķ�����Ԫ����ȣ��ǽ����Խ�ǿ����C����Ԫ�ط��ţ���д��һ����֤����Ľ��۵Ļ�ѧ����ʽNa2SiO3+CO2+H2O=Na2CO3+H2SiO3����
��3�����¶Ⱥ�������������£���˵����Ӧ�Ѵﵽƽ��״̬����ac��ѡ���ţ�
a��CH3OH������������CH3OCH3����������֮��Ϊ2��1
b��������ѹǿ���ֲ���
c��H2O��g��Ũ�ȱ��ֲ���
d������ƽ����Է����������ֲ���
��4��һ���¶��£����������ԼΪ2.0L�ĺ����ܱ������з���������Ӧ��
| ���� ��� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
| CH3OH��g�� | CH3OCH3��g�� | H2O��g�� | ||
| I | 387 | 0.40 | 0.16 | 0.16 |
| �� | 387 | 0.80 | a | |
| �� | 207 | 0.40 | 0.18 | 0.18 |
a����ʱ���߲��� b�������¶� c������CH3OHd�������¶�
��I�������ڵķ�Ӧ����t min�ﵽƽ�⣬��CH3OH��ƽ����Ӧ����Ϊ$\frac{0.16}{t}$mol/��L��min�����ú�t��ʽ�ӱ�ʾ����II��������a=0.32mol��
��5������ʼʱ������I�г���CH3OH 0.2mol��CH3OCH30.30mol��H2O 0.20mol����Ӧ����������������桱����Ӧ������У�
7�����е���ʽ��ṹʽ������ǣ�������
| A�� | ���������ӵĵ���ʽ��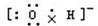 | B�� | NH4Br�ĵ���ʽ��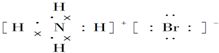 | ||
| C�� | ���Ȼ�̼�ĵ���ʽ��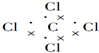 | D�� | H2O�Ľṹʽ��H-O-H |
 ��������������ȫ����ע��CO��CO2��Ӧ�öԹ�����̬��������Ҫ���壮
��������������ȫ����ע��CO��CO2��Ӧ�öԹ�����̬��������Ҫ���壮