题目内容
12.在2A(g)+B(g)?3C(g)+4D(g)反应中,表示该反应速率最快的是( )| A. | v(A)=0.5mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=1 mol•L-1•s-1 |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,注意保持单位一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,对于N2+3H2?2NH3,
A.$\frac{v(A)}{2}$=0.25mol•L-1•s-1;
B.$\frac{v(B)}{1}$=0.3mol•L-1•s-1;
C.$\frac{v(C)}{3}$=0.2mol•L-1•s-1;
D.$\frac{v(D)}{4}$=0.25mol•L-1•s-1,
故反应速率v(B)>v(A)=v(D)>v(C),
故选B.
点评 本题考查化学反应速率快慢比较,难度不大,可以转化为同一物质表示的速率比较,利用比值法可以快速判断,注意对熟练公式的理解与灵活应用.

练习册系列答案
相关题目
3.1989年,IUPAC(国际纯粹与应用化学联合会)建议用1~18列替代原主族、副族等.下列有关说法错误的是( )
| A. | 元素周期表中第3列的元素种类数最多 | |
| B. | 金属性最强的元素位于元素周期表的第1列 | |
| C. | 非金属性最强的元素位于元素周期表的第17列 | |
| D. | 能形成化合物的种类数最多的元素位于元素周期表的第16列 |
7.在同温同压下,下列各组热化学方程式中,△H1>△H2的是( )
| A. | 2H2(g)+O2(g)=2H2O(g)△H1 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H1 C(s)+O2(g)=CO2 (g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
17.下列属于链烃的是( )
| A. | CH3CH2Cl | B. | 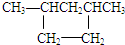 | C. | 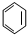 | D. | CH4 |
4.银锌电池广泛用作电子仪器的电源,它的充电和放电过程可表示为:
Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2.此电池放电时负极反应的生成物是( )
Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2.此电池放电时负极反应的生成物是( )
| A. | Ag | B. | Zn(OH)2 | C. | Ag2O | D. | Zn |
1.短周期非金属元素甲~戊在元素周期表中的相对位置如表所示,下面判断不正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 非金属性:乙>丁 | |
| C. | 最高价氧化物的水化物的酸性:丙<丁 | |
| D. | 最外层电子数:丙>丁>戊 |
2.纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液.放电时两个电极反应分别为:Zn+2OH-→Zn(OH)2+2e-Ag2O+H2O+2e-→2Ag+2OH- 下列说法中正确的是( )
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 在电池放电的过程中,电解质溶液的碱性变大 |

 +H2O;n HOCH2CH2OH+n HOOC-COOH
+H2O;n HOCH2CH2OH+n HOOC-COOH 
 +(2n-1)H2O.
+(2n-1)H2O.