题目内容
1.短周期非金属元素甲~戊在元素周期表中的相对位置如表所示,下面判断不正确的是( )| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 非金属性:乙>丁 | |
| C. | 最高价氧化物的水化物的酸性:丙<丁 | |
| D. | 最外层电子数:丙>丁>戊 |
分析 A.同周期自左而右原子半径减小;
B.同主族从上到下元素的非金属性减弱;
C.同周期从左向右非金属性增强,非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.同周期从左向右最外层电子数增大.
解答 解:A.同周期自左而右原子半径减小,则原子半径为甲>乙,故A正确;
B.同主族从上到下元素的金属性增强,则非金属性为乙>丁,故B正确;
C.同周期从左向右非金属性增强,非金属性越强,对应的最高价氧化物的水化物的酸性越强,故最高价含氧酸的酸性:丙<丁,故C正确;
D.同周期从左向右最外层电子数增大,则最外层电子数为丙<丁<戊,故D错误;
故选:D.
点评 本题考查元素周期律和元素周期表,注意熟悉掌握同主族、同周期元素性质的变化规律,题目难度不大.

练习册系列答案
相关题目
11.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| C | 浓氨水 | 生石灰 | AlCl3溶液 | Al(OH)3具有两性 | |
| D | 醋酸 | Na2CO3 | Na2SiO3 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |
12.在2A(g)+B(g)?3C(g)+4D(g)反应中,表示该反应速率最快的是( )
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=1 mol•L-1•s-1 |
9.常温下,能促进水的电离的物质是( )
| A. | 醋酸 | B. | NaOH溶液 | C. | Na2CO3溶液 | D. | 硫酸 |
6.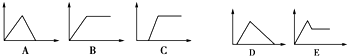 在图中,横坐标为向一定量的某溶液中加入某物质的量,纵坐标为生成沉淀的量.从图A~E中,选择适合表中各题要求的序号填入表中.
在图中,横坐标为向一定量的某溶液中加入某物质的量,纵坐标为生成沉淀的量.从图A~E中,选择适合表中各题要求的序号填入表中.
 在图中,横坐标为向一定量的某溶液中加入某物质的量,纵坐标为生成沉淀的量.从图A~E中,选择适合表中各题要求的序号填入表中.
在图中,横坐标为向一定量的某溶液中加入某物质的量,纵坐标为生成沉淀的量.从图A~E中,选择适合表中各题要求的序号填入表中.| 溶液 | 加(通)入物质 | 序号 |
| (1)饱和石灰水 | 通入过量CO2 | |
| (2)AlCl3溶液 | 加入过量的NH3•H2O | |
| (3)含少量NaOH的Na[Al(OH)4]溶液 | 通入过量CO2 | |
| (4)含少量NaOH的Na[Al(OH)4]溶液 | 逐滴加入稀盐酸 | |
| (5)MgCl2、AlCl3混合液 | 逐滴加入NaOH溶液至过量 | |
| (6)NaOH溶液 | 逐滴加入AlCl3溶液至过量 |
13.乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明正确的是( )

| A. | 和金属钠作用时,键②断裂 | |
| B. | 和浓H2SO4共热至170℃时,键②和⑤断裂 | |
| C. | 在Ag催化剂下和O2反应时,键①和③断裂 | |
| D. | 和CH2COOH共热时,键②断裂 |
10.将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混合溶液中,下列关系式正确的是( )
| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)=c(NH4+)>c(H+)=c(OH-) | D. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
11.下列说法正确的是( )
| A. | HCHO溶液、(NH4)2SO4溶液均能使蛋白质变性 | |
| B. | 分子式为C2H4O2的有机物不一定是羧酸 | |
| C. | 煤的干馏是物理变化,煤的气化和液化是化学变化 | |
| D. | 纤维素、蛋白质、油脂、糖类在一定条件下都能发生水解反应 |
