题目内容
2.${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H互为A,16O2、18O3互为C.A.同位素 B.相同物质 C.同素异形体 D.同分异构体.
分析 具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;同素异形体是同种元素形成的不同单质.
解答 解:${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H具有相同质子数、不同中子数同一元素的不同原子,互为同位素;
16O2和18O3 是同种元素形成的不同单质,互为同素异形体.
故答案为:A;C.
点评 本题主要考查了同位素,同素异形体的定义,难度不大,在判断时要抓住各自的研究对象分别为:原子、单质.

练习册系列答案
相关题目
13.根据总反应式:Zn+Cu2+=Zn2++Cu,请分析下述原电池的组成,对应正确的一组是( )
| A | B | C | D | |
| 正极 | Cu | Cu | Zn | Ag |
| 负极 | Zn | Zn | Cu | Cu |
| 电解质溶液 | CuSO4 | AgNO3 | CuCl2 | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
10.常温下,0.1mol•L-1HX的pH=1,0.1mol•L-1CH3COOH的pH=2.9.下列说法不正确的是( )
| A. | HX和CH3COOH均可抑制水的电离 | |
| B. | 将HX与CH3COOH 各0.1mol溶于水配成1L混合溶液,则溶液的c(H+)=0.2 mol•L-1 | |
| C. | 将等物质的量浓度、等体积的HX与CH3COONa两溶液混合后所得溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+) | |
| D. | 0.3mol•L-1的CH3COOK溶液:c(CH3COO-)+c(CH3COOH)=c(K+) |
17.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1mol Fe与足量的盐酸反应,转移3nA个电子 | |
| B. | 0.1mol•L-1的NaNO3溶液中含有0.1nA个NO3- | |
| C. | 常温下,34gNH3含有2nA个NH3分子 | |
| D. | 常温常压下,22.4LNO2含有2nA个氧原子 |
7.下列物质的分子中,所有的原子都在同一平面上的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 甲苯 | D. | 溴乙烷 |
14.下表是周期表的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答问题:
(1)表中元素,化学性质最不活泼的是Ar,只有负价而无正价的是F,可用于制半导体材料的元素是Si.
(2)最高价氧化物的水化物碱性最强的物质的电子式是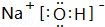 ,酸性最强的物质是HClO4,呈两性的物质是Al(OH)3;
,酸性最强的物质是HClO4,呈两性的物质是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物是HF;
(4)B元素与A形成的化合物和水反应后溶液呈碱性,同时生成一种可燃气体,写出反应的化学方程式NaH+H2O=NaOH+H2↑.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)最高价氧化物的水化物碱性最强的物质的电子式是
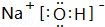 ,酸性最强的物质是HClO4,呈两性的物质是Al(OH)3;
,酸性最强的物质是HClO4,呈两性的物质是Al(OH)3;(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物是HF;
(4)B元素与A形成的化合物和水反应后溶液呈碱性,同时生成一种可燃气体,写出反应的化学方程式NaH+H2O=NaOH+H2↑.
11.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 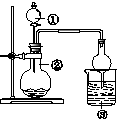 |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| C | 浓氨水 | 生石灰 | AlCl3溶液 | Al(OH)3具有两性 | |
| D | 醋酸 | Na2CO3 | Na2SiO3 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |
12.在2A(g)+B(g)?3C(g)+4D(g)反应中,表示该反应速率最快的是( )
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=1 mol•L-1•s-1 |
 ;
; ,在核磁共振氢谱中出现5组峰.
,在核磁共振氢谱中出现5组峰.