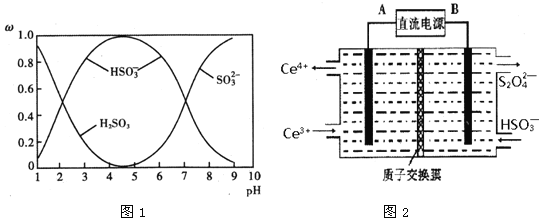
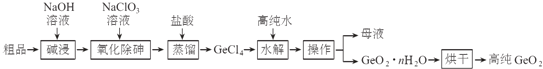
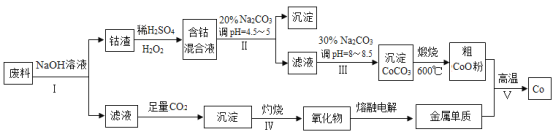
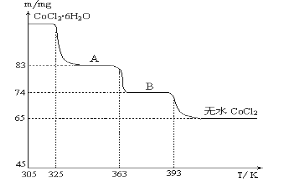
��Ŀ����
����Ŀ��������Ϣ��ҵ��̫���ܵ�ع��ת���Ļ������ϡ�п��ԭ���Ȼ�����һ����������Ӧ��ǰ�����Ʊ���ķ��������Ʊ�����ʾ�����£�

��1����̿�ڹ��̢�����______����
��2�����̢��е�Cl2�õ�ⱥ��ʳ��ˮ�Ʊ����Ʊ�Cl2�Ļ�ѧ����ʽ��____��
��3�������Ʊ����̱����ϸ������ˮ��
��SiCl4��ˮ����ˮ������SiO2��һ���ᣬ��Ӧ�Ļ�ѧ����ʽ��_____��
�ڸ���Cl2ʱ���������ڳ�ָ���Ͳ�����ȫ�ĽǶȿ��ǣ��轫Լ90��ij�ʪ��������ȴ��12�棬Ȼ����ͨ�뵽ŨH2SO4�С���ȴ��������____��
��4��Zn��ԭSiCl4�ķ�Ӧ���£�
��Ӧ1�� 400�桫756�� ��SiCl4(g) + 2Zn(l)![]() Si(s) + 2ZnCl2(l) ��H1<0
Si(s) + 2ZnCl2(l) ��H1<0
��Ӧ2�� 756�桫907�� ��SiCl4(g) + 2Zn(l)![]() Si(s) + 2ZnCl2(g) ��H2<0
Si(s) + 2ZnCl2(g) ��H2<0
��Ӧ3�� 907�桫1410�棬SiCl4(g) + 2Zn(g)![]() Si(s) + 2ZnCl2(g) ��H3<0
Si(s) + 2ZnCl2(g) ��H3<0
�� ��������������Ӧ������˵����������_____��
a�������¶Ȼ����SiCl4��ת���� b����ԭ�������������������н���
c������ѹǿ����߷�Ӧ������ d��Na��Mg���Դ���Zn��ԭSiCl4
�� ʵ���Ʊ�����ѡ������Ӧ3����ѡ���������____��
�� ��֪Zn(l)=Zn(g) ��H = +116 KJ/mol ����SiCl4��ת���ʾ�Ϊ90%��ÿͶ��1mol SiCl4������Ӧ3��������Ӧ2����ų�_____kJ��������
��5���ù�����̫���ܵ��ʱ��Ϊ�������ڹ����ķ��䣬���û�ѧ��ʴ����������γɴֲڵĶ��㡣��ʴ������ϡHNO3��HF�Ļ��Һ������������γ�SiO2�����ת��ΪH2SiF6���û�ѧ����ʽ��ʾSiO2ת��ΪH2SiF6�Ĺ���_____��
���𰸡���ԭ 2NaCl + 2H2O![]() 2NaOH + Cl2��+ H2�� SiCl4+ 2H2O = SiO2+ 4HCl ʹˮ�������������ٽ���Ũ�����ˮ�������ֳ�������ˮ�ԣ������ͷų������� b c d �¶ȸߣ���Ӧ���ʿ죻��ǰ������Ӧ�Ƚϣ�������ʹ����� 208��8 SiO2+6HF = H2SiF6+ 2H2O
2NaOH + Cl2��+ H2�� SiCl4+ 2H2O = SiO2+ 4HCl ʹˮ�������������ٽ���Ũ�����ˮ�������ֳ�������ˮ�ԣ������ͷų������� b c d �¶ȸߣ���Ӧ���ʿ죻��ǰ������Ӧ�Ƚϣ�������ʹ����� 208��8 SiO2+6HF = H2SiF6+ 2H2O
��������
��1�����ݷ�Ӧ��Ļ�ѧ����ʽ������̿����ԭ����
��2����ⱥ��ʳ��ˮ�Ʊ�Cl2�Ļ�ѧ����ʽ��2NaCl+2H2O![]() 2NaOH+Cl2��+H2����
2NaOH+Cl2��+H2����
��3����SiCl4ˮ������SiO2��HCl��
�ڸ���Cl2ʱ���������ڳ�ָ���Ͳ�����ȫ�ĽǶȿ�����ȴ�����á�
��4���� a�������¶ȶ�ƽ���Ӱ�죻 b��п�����ױ�������
c��ѹǿ�����ʵ�Ӱ�죻 d���ӻ�ԭ�ԽǶȷ���
�� �Ա�������Ӧ���ӷ�Ӧ�����Լ�״̬������
�� ��Ӧ�ȵļ����˹���ɵ�Ӧ�á�
��5��SiO2��HF��Ӧ����H2SiF6��
��1��̼��������跴Ӧ����ʽΪSiO2+2C![]() Si+2CO����̼Ԫ���ڷ�Ӧ�л��ϼ����ߣ�����������Ӧ��̼����ԭ���������ԭ��
Si+2CO����̼Ԫ���ڷ�Ӧ�л��ϼ����ߣ�����������Ӧ��̼����ԭ���������ԭ��
��2������Ȼ�����Һ�����������ơ�����������������ʽΪ��2NaCl+2H2O![]() 2NaOH+Cl2��+H2�������2NaCl+2H2O
2NaOH+Cl2��+H2�������2NaCl+2H2O![]() 2NaOH+Cl2��+H2����
2NaOH+Cl2��+H2����
��3���ٸ���SiCl4��ˮ����ˮ������SiO2��һ�������Ϣ����Ӧ����SiCl4��ˮ��������Ϊ�������裬������ԭ���غ㣬ˮ����ǰ��ϵ��Ϊ2��������ԭ�Ӻ���ԭ���غ㣬��һ����Ϊ�Ȼ��⣬�Ȼ���ǰ��ϵ��Ϊ4����ѧ��Ӧ����ʽΪSiCl4+2H2O�TSiO2+4HCl���ڳ�ʪ�����к��н϶��ˮ����������ȴ��12�棬��ʱʹˮ����������Ȼ����ͨ�뵽ŨH2SO4�У�����Ũ�����ˮ�����ˣ���֤Ũ�����������ˮ�ԣ�ˮ��Ũ�������÷��ȣ����Խ��������ˮ���ˣ��ܽ��ͷų��������������SiCl4+2H2O�TSiO2+4HCl����ʹˮ�������������ٽ���Ũ�����ˮ�������ֳ�������ˮ�ԣ������ͷų���������
��4���ٶ���������Ӧ����H��0����ʾ���Ƿ��ȷ�Ӧ��a�������¶ȣ�ƽ�������ȵķ����ƶ������Իή��SiCl4��ת���ʣ�a����b��Si�������ڸ��µ������·�Ӧ���ɶ������裬���Ի�ԭ�������������������н��У�b��ȷ��c��������μӵķ�Ӧ������ѹǿ���ܼӿ췴Ӧ�����ʣ�����������Ӧ������������룬��������ѹǿ������߷�Ӧ�����ʣ�c��ȷ��d��Na��Mg���ǻ�ԭ�ԱȽ�ǿ�Ľ��������Դ���Zn��ԭSiCl4��d��ȷ����ѡ��bcd���ڷ�Ӧ2�뷴Ӧ1�Ƚϣ���Ӧ2����Ϊ���������ȷ�Ӧ1�����ڷ��룬��Ӧ3�뷴Ӧ2�Ƚϣ���Ӧ�ﶼΪ��̬���¶ȸߣ���Ӧ���ʸ��죬����ʵ���Ʊ�����ѡ������Ӧ3�����¶ȸ߷�Ӧ���ʿ죻��ǰ������Ӧ�Ƚϸ�����ʹ����룬����¶ȸ߷�Ӧ���ʿ죻��ǰ������Ӧ�Ƚϸ�����ʹ����룻��ÿͶ��1mol SiCl4����2molZn�μӷ�Ӧ������Ӧ3��������Ӧ2���Ƚϣ���Ӧ2��пΪҺ̬������Zn��l���TZn��g����H=+116KJ/mol����SiCl4��ת���ʾ�Ϊ90%������Ӧ3��������Ӧ2����ų�116KJ/mol��2��90%=208��8KJ�����208��8��
��5���������������ᷴӦ��SiO2+4HF=SiF4��+2H2O��SiF4+2HF=H2SiF6��������ϡHNO3��HF�Ļ��Һ������������γ�SiO2�����ת��ΪH2SiF6�Ļ�ѧ����ʽΪSiO2+6HF�TH2SiF6+2H2O�����SiO2+6HF�TH2SiF6+2H2O��

 ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д� ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�