题目内容
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).

请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式______.
(2)含硫各微粒(H2SO3、![]() 和
和![]() )存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
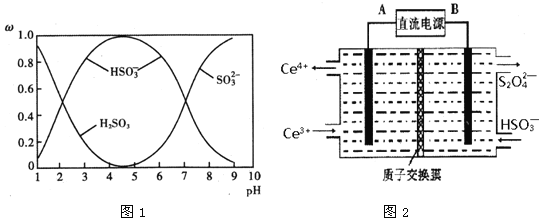
①下列说法正确的是______(填标号).
A.pH=7时,溶液中c(Na+)=3c(![]() )
)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(![]() )+c(H2SO3)
)+c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为______.
③取装置Ⅰ中的吸收液VmL,用cmol/L的酸性高锰酸钾溶液滴定,酸性高锰酸钾溶液应装在______(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是______
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.图中A为电源的______(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为______.
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为 0.4mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为______ L.
【答案】NO+H2O+Ce4+= Ce3++ NO2-+2H+ ABC 3SO2 + 5OH- = 2SO32-+ HSO3- + 2H2O 酸式 滴入最后一滴溶液呈紫红色且半分钟颜色不变 正 2HSO3- + 2e- +2 H+ = S2O42-+ 2H2O 4480
【解析】
(1)装置Ⅱ中NO和Ce4+在酸性条件下生成Ce3+和NO2-,根据氧化还原反应书写离子方程式。
(2)根据电荷守恒和图像及溶液的pH分析;根据物质的量的比例关系书写离子方程式;高锰酸钾装在酸式滴定管里,当最后一滴滴入,溶液变为紫红色,且半分钟内不变为原来颜色。
(3)根据化合价分析得到化合价升高,应在阳极反应,连接电源正极,右侧发生化合价降低的反应。
(4)亚硝酸根化合价升高,氧气化合价降低,根据升降守恒得出氧气的物质的量。
(1)装置Ⅱ中NO和Ce4+在酸性条件下生成Ce3+和NO2-的离子方程式NO+H2O+Ce4+= Ce3++ NO2-+2H+,故答案为:NO+H2O+Ce4+= Ce3++ NO2-+2H+。
(2)①A选项,根据电荷守恒和pH=7时,c(HSO3-) = c(SO32-),因此溶液中c(Na+)= c(HSO3-) +2 c(SO32-) =3 c(HSO3-),故A正确;
B选项,由图中数据,pH=7时,c(HSO3-) = c(SO32-),因此估算出H2SO3的第二级电离平衡常数Ka2≈10-7,故B正确;
C选项,由图1可知,为获得尽可能纯的NaHSO3,应将溶液的pH控制在4~5为宜;
D选项,pH = 9时溶液为亚硫酸钠和亚硫酸氢钠混合溶液,无法得出溶液中c(OH-)=c(H+) + c(HSO3-) +c(H2SO3),故D错误。
综上所述,答案为ABC。
②1L 1mol/L的NaOH溶液中含NaOH的物质的量为1 mol,NaOH完全吸收13.44L(标况下)SO2即0.6molSO2,NaOH和SO2的物质的量之比为5:3,则反应的总离子方程式为3SO2 + 5OH- = 2SO32-+ HSO3- + 2H2O,故答案为:3SO2 + 5OH- = 2SO32-+ HSO3- + 2H2O。
③酸性高锰酸钾溶液具有强氧化性,会腐蚀橡胶管,因此应装在酸式滴定管中,判断滴定终点的方法是滴入最后一滴溶液呈紫红色且半分钟颜色不变,故答案为:酸式;滴入最后一滴溶液呈紫红色且半分钟颜色不变。
⑶装置Ⅲ的作用之一是再生Ce4+,在阳极反应生成Ce4+,阳极连接电源的正极,因此A为电源正极,右侧反应室中发生的主要电极反应式为2HSO3- + 2e- +2 H+ = S2O42-+ 2H2O,故答案为:正;2HSO3- + 2e- +2 H+ = S2O42-+ 2H2O。
⑷已知进入装置Ⅳ的溶液中NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,即n(NO2-)= 0.4mol/L×1000L = 400mol,亚硝酸根升高2个价态,氧气降低4个价态,因此需400mol亚硝酸根与200mol氧气反应,向装置Ⅳ中通入标准状况下的O2的体积为200mol ×22.4 L/mol =4480 L,故答案为:4480。