题目内容
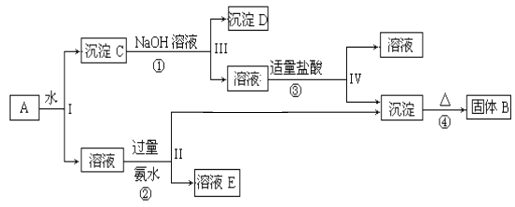
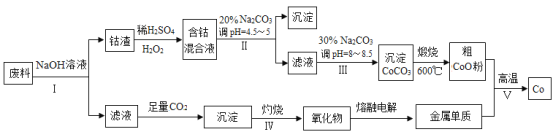
【题目】钴(Co)及其化合物在工业上广泛应用于磁性材料、电池材料及超硬材料等领域。某学习小组欲从某工业废料中回收钴,设计工艺流程如下:(废料中含有Al、Co2O3 和Fe2O3等物质)。
请回答:
(1)废料用NaOH溶液处理前通常先将废料粉碎,其目的是____________。
(2)过程Ⅱ用稀H2SO4和H2O2溶液与Co2O3反应而达到浸出钴的目的,请写出该反应的离子方程式___________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因______________。
(3)碳酸钠溶液在过程Ⅱ和Ⅲ中所起作用有所不同,请写出碳酸钠在过程Ⅱ中发生反应生成沉淀的离子方程式__________________________________。
(4) 若在实验室中完成过程Ⅳ,则沉淀物需在__________________(填仪器名称)中灼烧;写出在过程Ⅴ中发生反应的化学方程式__________________________________。
(5)将1.0×10-3 mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为__________ mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
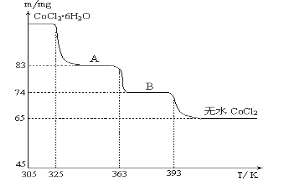
(6)CoO与盐酸反应可得粉红色的CoCl2溶液。CoCl2晶体因结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体在烘箱中受热分解时,剩余固体质量随温度变化的曲线,物质A的化学式是____________________。
【答案】增大反应物接触面积,加快反应速率 Co2O3+H2O2+4H+=2Co2++ O2+3H2O Co2O3可氧化盐酸产生Cl2,污染环境 2Fe3++3![]() +3H2O=2Fe (OH)3↓+3CO2↑ 坩埚 3CoO+2Al
+3H2O=2Fe (OH)3↓+3CO2↑ 坩埚 3CoO+2Al![]() 3Co+ A12O3 1.0×10-9 CoCl2·2H2O
3Co+ A12O3 1.0×10-9 CoCl2·2H2O
【解析】
第一步中,Al和氢氧化钠溶液反应,其离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,得到滤液和滤渣,因此采用操作步骤是过滤,滤液中AlO2-与二氧化碳反应得到氢氧化铝沉淀,之后灼烧并通过电解熔融氧化铝得到金属单质铝。滤渣中Co2O3作氧化剂与过氧化氢反应,化合价由+3价→+2价,之后调节PH得到Fe(OH)3。滤液中Co2+不能转化成沉淀,根据pH的范围为3.2≤pH<7.15调节PH得到碳酸钴沉淀之后进行煅烧得到氧化钴,与金属单质铝发生铝热反应得到金属单质Co。根据此分析进行解答。
(1)废料进行矿石粉碎处理,可以增大接触面积,加快反应速率,
故答案:为增大反应物接触面积,加快反应速率
(2)Co2O3作氧化剂与过氧化氢反应,化合价由+3价→+2价,故反应的离子方程式为Co2O3+H2O2+4H+=2Co2++ O2+3H2O。HCl被氧化后,Cl由-1价→0价,反应离子反应方程式为Co2O3+2Cl-+6H+=2Co2++3H2O+Cl2↑,会产生氯气污染环境,
故答案为:Co2O3+H2O2+4H+=2Co2++ O2+3H2O Co2O3可氧化盐酸产生Cl2,污染环境
(3)在过程Ⅱ中Fe3+与碳酸根发生双水解,转化成Fe(OH)3,但Co2+不能转化成沉淀。碳酸钠在过程Ⅱ中发生反应生成沉淀的离子方程式为2Fe3++3![]() +3H2O=2Fe (OH)3↓+3CO2↑,
+3H2O=2Fe (OH)3↓+3CO2↑,
故答案为:2Fe3++3![]() +3H2O=2Fe (OH)3↓+3CO2↑
+3H2O=2Fe (OH)3↓+3CO2↑
(4)过程Ⅳ是将Al(OH)3 灼烧生成Al2O3,需要在坩埚中进行,电解熔融氧化铝得到金属单质铝,过程Ⅴ中氧化钴与金属单质铝发生铝热反应得到金属单质Co,化学方程式为3CoO+2Al![]() 3Co+ A12O3,
3Co+ A12O3,
故答案为:坩埚; 3CoO+2Al![]() 3Co+ A12O3
3Co+ A12O3
(5)Co2+与CO32-结合成CoCO3沉淀,此时碳酸根的浓度为(1.2×10-3-1.0×10-3)÷2=1×10-4,故Co2+的浓度=![]() mol/L,
mol/L,
故答案为: 1.0×10-9
(6)由图可知n(CoCl2)=65×10-3÷130=5×10-4mol,物质A中含有的结晶水的物质的量为n(H2O)=(83-65)×10-3÷18=1×10-3mol,故n(CoCl2)∶n(H2O)=1:2,故物质A的化学式为CoCl2·2H2O,
故答案为:CoCl2·2H2O

【题目】断裂1mol化学键所需要的能量如下:
化学键 | N-N | O=O | N≡N | N-H |
键能kJ·mol-1 | a | 500 | 942 | 391 |
肼(N2H4)的有关反应能量变化如图所示,下列说法正确的是( )

A. 该图表示:1molN2H4与1molO2反应生成1molN2和2molH2O反应热△H=-2752kJ·mol-1
B. a=154
C. N2(g)+2H2O(g)=N2H4(g)+O2(g) △H=+2752kJ·mol-1
D. 当有2molH2O(g)生成时,放出534kJ·mol-1的热量