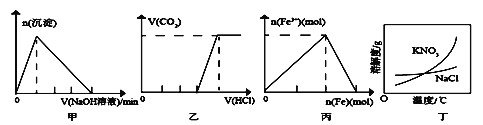
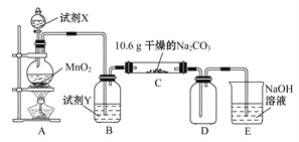
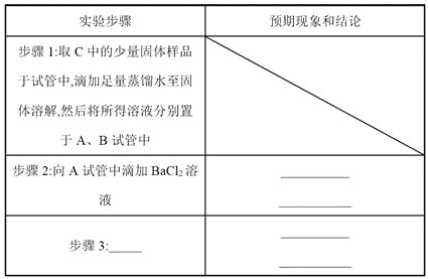
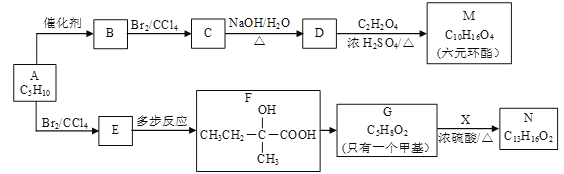
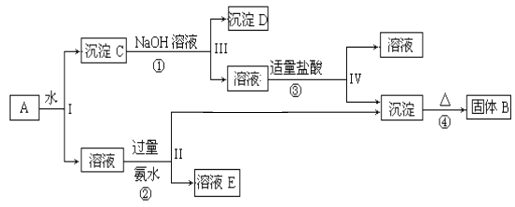
题目内容
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____方法区分晶体、准晶体和非晶体。
(2)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A.离子键 B.σ键 C.π键 D.配位键 E.范德华力
(4)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=____g/cm3。

【答案】X-射线衍射 ![]() V型 H2O NH2- F>N>O>B sp3 ABD
V型 H2O NH2- F>N>O>B sp3 ABD ![]()
【解析】
(1)晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间;
(2)Sb的价电子为5s能级上2个电子、5p能级上3个电子;
[H2F]+与H2O、NH2-等互为等电子体,结构相似;
(3)①涉及的第二周期元素有B、N、O、F元素,第二周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
②[B(OH)4]-中B原子价层电子对个数是4,根据价层电子对互斥理论判断B原子杂化类型;
③NH4BF4中阴阳离子之间存在离子键,N原子和H原子之间存在共价键且其中一个是配位键,B原子和F原子之间存在共价键且其中一个是配位键,共价单键为σ键;
(4)先根据均摊方法确定晶胞中含有的As、Ni原子个数,在计算晶胞的体积,最后根据![]() 计算。
计算。
(1)从外观无法区分三者,但用X光照射会发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无X射线衍射现象即可确定;
(2)Sb的价电子为5s能级上2个电子、5p能级上3个电子,所以其价电子轨道式为![]() ;
;
[H2F]+与H2O、NH2-等互为等电子体,结构相似,为V形;
(3)①涉及的第二周期元素有B、N、O、F元素,第二周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族元素的原子核外处于其轨道的全充满稳定状态、第VA族元素原子核外电子处于其轨道的半充满的稳定状态,因此它们的第一电离能大于相邻元素,B、N、O、F分别位于第IIIA族、第VA族、第VIA族、第VIIA族,所以第一电离能大小顺序为F>N>O>B;
②[B(OH)4]-中B原子价层电子对个数是4,根据价层电子对互斥理论判断B原子杂化类型为sp3杂化;
③NH4BF4中阴、阳离子之间存在离子键,N原子和H原子之间存在共价键结合且其中有一个是配位键,B原子和F原子之间存在共价键且其中一个是配位键,共价单键为σ键,所以四氟硼酸铵中存在离子键、σ键、配位键,故合理选项是ABD;
(4)根据砷镍合金的晶胞示意图可知该晶胞中As原子个数是2、Ni原子个数=4×![]() +4×
+4×![]() +2×
+2×![]() +2×
+2×![]() =2,其体积=(a×10-10cm×a×10-10cm×
=2,其体积=(a×10-10cm×a×10-10cm×![]() )×c×10-10 cm=
)×c×10-10 cm=![]() a2c×10-30cm3,晶胞密度ρ=
a2c×10-30cm3,晶胞密度ρ=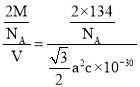 g/cm3=
g/cm3=![]() g/cm3。
g/cm3。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
Si | Fe | Cu | Mn | Mg | Cr | Zn | Ti | Al | |
罐身/% | 0.3 | 0.7 | 0.25 | 0.25 | 1.0~1.5 | - | - | - | 其余 |
罐盖/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 4.0~5.0 | - | 0.1 | 0.25 | 其余 |
拉环/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 3.0~4.0 | 0.1 | 0.25 | 0.1 | 其余 |
为了验证罐身的组成成分,进行了如下实验:
(实验仪器与药品)
仪器:酒精灯、烧杯、试管、试管夹、漏斗、滤纸、铁圈、玻璃棒、砂纸、剪刀
药品:易拉罐、去污粉、NaOH溶液、KSCN溶液、盐酸、镁试剂、高碘酸(H5IO6,弱酸)
(实验方案)
实验预处理。将剪好的易拉罐片用砂纸打磨,除去表面的涂料层,直到光亮后用去污粉清洗干净备用。
(实验过程)分别向试管a、b中加入少量上述易拉罐片,进行如下操作:
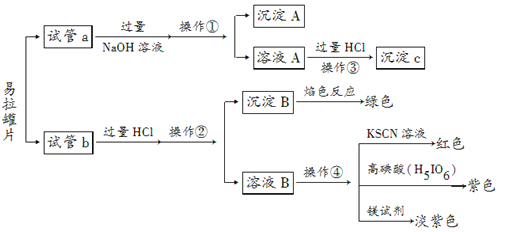
请填写下列空白:
(1)图中操作①②所用到的玻璃仪器有______________________________。
(2)沉淀A的成分为________。
(3)操作③观察到的现象为_____________________________________;反应的离子方程式为____________________________________________。
(4)若试管a、b中取样量相等,则分别加入过量的NaOH溶液、稀盐酸后,相同条件下理论上产生的气体体积V(a)________V(b)(填“<”、“>”或“=”)。