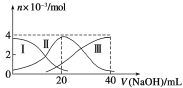
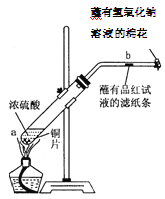
题目内容
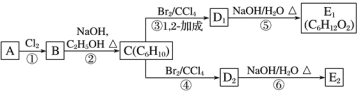
【题目】已知有以下物质相互转化:

请回答下列问题:
(1)写出B的化学式___________,D的化学式为____________;
(2)写出由E转变成F的化学方程式________。
(3)写出D转化成H的离子方程式_________。
(4)除去溶液B中混有的少量G溶液的最适宜方法是________。
【答案】FeCl2 KCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Ag++Cl-=AgCl↓ 向溶液B中加入足量铁粉,再经过滤操作
【解析】
D和硝酸银、稀硝酸的混合溶液反应生成沉淀H和焰色反应呈紫色的溶液可知,H为AgCl,D为KCl,白色沉淀E在空气中变成红褐色沉淀F可知E为Fe(OH)2,F为Fe(OH)3,所以G为FeCl3,A为Fe,B为FeCl2,C为NaOH,据此解答。
(1)由分析可知,B为FeCl2,D为KCl,故答案为:FeCl2;KCl;
(2)E为Fe(OH)2,F为Fe(OH)3,反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)D为KCl,H为AgCl,D转化为H的离子方程式为:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓;
(4)FeCl2中混有的少量FeCl3,可用过量的铁粉将FeCl3转化为FeCl2,过量的铁粉用过滤除去,故答案为:向溶液B中加入足量铁粉,再经过滤操作。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】高铁酸盐在能源、环保等方面有着广泛的用途。利用湿法、干法制备高铁酸盐的原理如表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上利用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
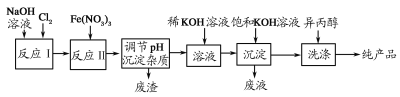
①反应Ⅰ的化学方程式为_____________。
②反应Ⅱ的离子方程式为_______________。
③加入饱和KOH溶液的目的_____________。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为___________。
(3)干法制备K2FeO4的反应中,氧化剂是________。
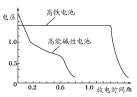
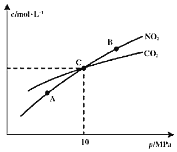
(4)高铁电池是正在研制中的可充电干电池,如图为该电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有________、________。